Дата создания: 26 марта 2019
Обновлено: 23 апреля 2023
Анализ влияния кетогенной диеты на микробиоценоз кишечника детей с эпилепсией
Анализ влияния кетогенной диеты на микробиоценоз кишечника детей с эпилепсией. Подробный разбор исследования.
Недавно Дмитрий Веремеенко опубликовал обзор нескольких исследований [1] где представлены категорические минусы кетогенной диеты (КД), после чего, с некоторыми кето-последователями, кето-гуру и особенно врачами, практикующими и рекомендующими кето повсеместно как «образ жизни», возник спор по поводу рационального использования данной диеты и всестороннего положительного влияния на организм человека. Некоторые известные врачи-специалисты применяют КД на пациентах с различными патологиями: генетические мутации в метаболизме аминокислот, сахарный диабет 1 и 2 типа (СД 1 и 2), расстройства аутистического спектра (РАС), эпилепсия, целиакия, псориаз, другие аутоиммунные заболевания. После того как я (Примечание: я - это автор настоящей статьи - Безродный Святослав Леонидович, научный сотрудник лаборатории диагностики и профилактики инфекционных заболеваний ФБУН МНИИ эпидемиологии и микробоилогии им. Г. Н. Габричевского специалист в области микробного сообщества кишечника человека) вступил в полемику с этими врачами, я был тут же заблокирован. Создается впечатление, что эти личности избегают других специалистов, их мнения и знаний по данному вопросу, а конкретно меня, они боятся, как «первобытные люди – огня» …, но не в этом суть, перейдем к самому исследованию и его описанию.
КД при всех своих положительных сторонах, имеет ряд ограничений и побочных эффектов, которые наблюдаются при длительном использовании данной диеты. Одно из важнейших влияний КД происходит на микробиоценоз кишечника человека. Для того чтобы показать, как КД влияет на микробиоту было подробно рассмотрено шведское исследование, проведенное совместно с коллегами из США и Израиля: «Кетогенная диета влияет на таксономический и функциональный состав микробиоты кишечника у детей с тяжелой эпилепсией»
Ссылка на это исследование:
- www.ncbi.nlm.nih.gov/pmc/articles/PMC6344533
В данном исследовании методом метагеномного секвенирования ДНК изучались таксономический и функциональный состав фекальной микробиоты 12 детей (4-М и 8-Ж; средний возраст 7,7 ± 4,5) с устойчивой к терапии эпилепсией до и после применения кетогенной диеты (КД). В исследовании применяется классическая КД, которая рассчитывается как соотношение жира к белку и углеводам от 2: 1 до 4: 1. Соотношение 4: 1 содержит 4 части жира и 1 часть белков и углеводов вместе (в г). При соотношении 4: 1- 70–90% потребляемой энергии происходит из жира и соответственно кетоновых тел. Дети следовали классической КД с соотношением от 3: 1 до 4: 1. Образцы фекалий от пациентов были получены до начала КД и через 3 месяца после КД. Уровни кетонов в крови: β-гидрокси-масляной кислоты составляли 0,3 ± 0,2 (среднее значение ± стандартное отклонение), диапазон 0,1 –0,8 до начала диеты и 4,1 ± 1,2 с диапазоном 1,4–5,6 ммоль / л через 3 месяца. Уровень глюкозы в крови снизился с 4,9 ± 0,5 до 4,3 ± 0,4 ммоль / л во время применения КД.
Микробное разнообразие. В статье проведена оценка микробного разнообразия по трем характеристикам: общее количество метагеномных таксономических единиц (mOTU), общее видовое богатство (Chao1) и индекс равномерности разнообразия Шеннона (Shannon). У детей после применения КД обнаружено уменьшение бактериального разнообразия по всем трем характеристикам, что хорошо представлено на диаграмме «ящик с усами», однако изменения недостоверны.
Бактериальные типы. При рассмотрении бактериальных типов в толстокишечном микробном сообществе детей после КД выявлено уменьшение относительной численности (количество генов OTU) Actinobacteria и Firmicutes, и увеличение относительной численности Bacteroidetes и Proteobacteria. Для характеристики фекальной микробиоты, далее было рассмотрено более подробное описание микробного сообщества по бактериальным семействам, родам и видам у детей до и после КД. На основании дополнительного материала к статье было проанализировано более подробно микробное сообщество толстого кишечника детей до и после применения КД. Составлены процентные диаграммы для основных клинически значимых бактериальных родов и видов, которые представлены в данном исследовании.
Бактериальные рода и виды. В микробиоценозе детей с эпилепсией методом метагеномного секвенирования ДНК не обнаружено геномных последовательностей микроорганизмов родов: Methanosphaera, Mobiluncus, Olsenella, Dysgonomonas, Bacillus, Listeria, Staphylococcus, Granulicatella, Leuconostoc, Lactococcus, Butyricicoccus, Butyrivibrio, Peptostreptococcus, Solobacterium, Turicibacter, Mitsuokella, Enterobacter, Morganella, Haemophilus, Pseudomonas. Эти рода микроорганизмов были выявлены в фекальной микробиоте родителей, не использовавших КД, которые были взяты в данном исследовании в качестве контроля. Можно сделать вывод, что микробное сообщество родителей более устойчиво и более разнообразно по сравнение с детским микробным сообществом, применяющих КД. Далее, эти рода микроорганизмов и кишечный микробиоценоз родителей рассматриваться не будут, т.к. нас интересует влияние КД на микробиоценоз.
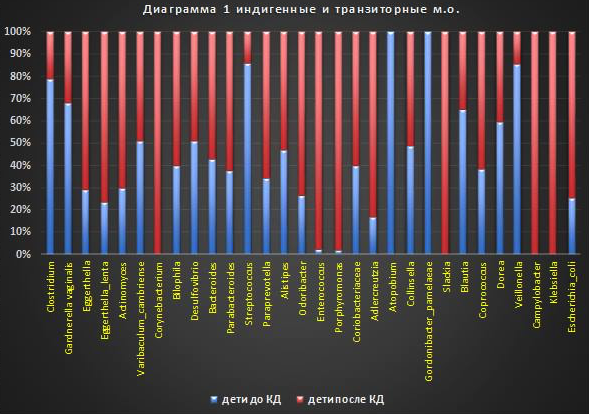 В микробиоценозе детей после применения КД обнаружено уменьшение количества (генов OTU) более чем в 2 раза родов и видов* комменсальных и транзиторных микроорганизмов: Clostridium, Gardnerella_vaginalis*, Varibaculum (Varibaculum_cambriense*), Ruminococcus, Desulfovibrio, Streptococcus parasanguinis*, Atopobium_vaginae*, Gordonibacter_pamelaeae*, Blautia, Dorea, Veillonella. См. диаграмму 1.
В микробиоценозе детей после применения КД обнаружено уменьшение количества (генов OTU) более чем в 2 раза родов и видов* комменсальных и транзиторных микроорганизмов: Clostridium, Gardnerella_vaginalis*, Varibaculum (Varibaculum_cambriense*), Ruminococcus, Desulfovibrio, Streptococcus parasanguinis*, Atopobium_vaginae*, Gordonibacter_pamelaeae*, Blautia, Dorea, Veillonella. См. диаграмму 1.
При подробном описании каждого вида и рода микроорганизмов у меня получился «отчет» более чем на 15 страниц, поэтому я не буду давать описание каждого вида и рода, а представлю только выборочно некоторые наиболее интересные из них.
- Gardnerella_vaginalis и Atopobium_vaginae являются условными патогенами, которые обнаруживается в 80% случаев у женщин с бактериальным вагинозом [8, 9], они имеют место при инфекциях половых путей, поэтому мы их не будем рассматривать.
- Desulfovibrio desulfuricans и D. piger являются грамотрицательными сульфатредуцирующими бактериями. Эти виды обнаружены в кишечнике здоровых людей, однако большая численность этого рода может быть связана с некоторыми ЖК заболеваниями, такими как воспалительные заболевания кишечника [4] . Так же представители данного рода обладают биоремедиацией для токсичных радионуклидов и тяжелых металлов [5]. Они практически не изменяются при использовании КД.
- Gordonibacter_pamelaeae был выделен из толстой кишки пациента, страдающего от острой болезни Крона [10]. Это строго анаэробный условно-патогенный микроорганизм, уменьшение его количества после применения КД несомненный плюс.
- Ruminococcus. Этот род микроорганизмов описывался ранее в другом шведском исследовании [ссылка на описание и само исследование-2], где так же было продемонстрировано влияние кетогенной диеты на микробиоценоз людей, поэтому здесь он рассматриваться не будет.
- Streptococcus parasanguinis является представителем здоровой микробиоты полости рта и оппортунистическим патогеном инфекционного эндокардита при протезировании клапанов сердца. Вызывает бактериемию при попадании в кровоток через раны в полости рта. Его количество уменьшается (диаграмма 1) в микробиоценозе детей, и это хорошо.
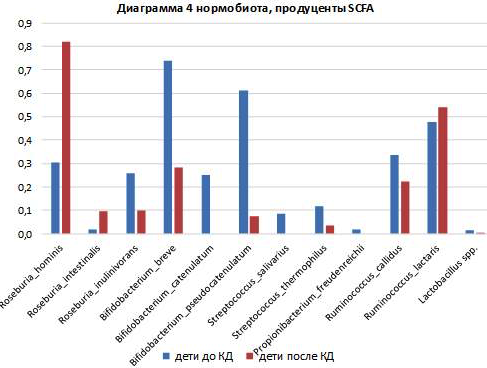 Однако два других вида Streptococcus_thermophilus и Streptococcus_salivarius являются представителями нормобиоты кишечника. S. salivarius продуцируют BLIS (бактериоцино-подобные ингибиторные вещества), которые являются антимикробными пептидами, также продуцирует SCFA (лактат). Streptococcus thermophilus так же продуцирует SCFA (лактат), сбраживает лактозу, является синергетическим для Lactobacillus delbrueckii, обеспечивая ее фолиевой кислотой и муравьиной кислотой, которые используются для синтеза пуринов. Их уменьшение может привести к колонизации экологической ниши другими условно-патогенными и патогенными микроорганизмами и развитию дисбиоза. См. диаграмму 4.
Однако два других вида Streptococcus_thermophilus и Streptococcus_salivarius являются представителями нормобиоты кишечника. S. salivarius продуцируют BLIS (бактериоцино-подобные ингибиторные вещества), которые являются антимикробными пептидами, также продуцирует SCFA (лактат). Streptococcus thermophilus так же продуцирует SCFA (лактат), сбраживает лактозу, является синергетическим для Lactobacillus delbrueckii, обеспечивая ее фолиевой кислотой и муравьиной кислотой, которые используются для синтеза пуринов. Их уменьшение может привести к колонизации экологической ниши другими условно-патогенными и патогенными микроорганизмами и развитию дисбиоза. См. диаграмму 4.- Blautia - род грамположительных анаэробных бактерий, являются резидентами толстой кишки человека, утилизируют диоксид углерода и водород, продуцируют SCFA – ацетат. Входят в филогенетическое ядро микробиоценоза кишечника человека. Снижает патогенность некоторых инфекционных возбудителей [11]. Уменьшение количества этих бактерий может привести к занятию экологической низши другими условно-патогенными представителями. Количество бактерий Blautia в ЖКТ уменьшается с возрастом человека, их число снижается у больных колоректальным раком. Наоборот, повышенные уровни Blautia spp. наблюдаются при синдроме раздражённого кишечника (СРК), однако предположительно, что последнее может отражать адаптацию экосистемы к увеличенному количество газов, продуцируемых Dorea spp., которые могут потребляться Blautia spp.
- Dorea – род грамположительных микроорганизмов, большинство из которых не продуцируют SCFA - бутират, пропионат, лактат, но продуцируют - ацетат и формиат. У больных колоректальным раком в тканях аденом обнаруживается повышенное содержание микроорганизмов данного рода [12]. Онако, количество микроорганизмов рода Dorea уменьшается у людей с ВЗК и острым колитом, что позволяет предположить, что эти организмы важны для поддержания кишечного гомеостаза [13].
- Veillonella spp. (характерные виды V. atypica и V. parvula) входят в состав нормобиоценоза человека (резиденты), превращают лактат в пропионат и ацетат, и некоторые другие метаболиты, следовательно, являются одними из основных м.о. поддерживающих баланс и соотношение SCFA. V. parvula являются парадонтогенными микроорганизмами, и в полости рта приводят к деминерализации эмали, образуют зубные бляшки. Виды Veillonella являются редкими причинами серьезных инфекций, таких как менингит, остеомиелит, протезная инфекция суставов, плевропульмональная инфекция, эндокардит и бактериемия [15]. Исследователи из Канады продемонстрировали, что снижение в раннем детстве относительного содержания в кишечнике бактерий группы FLVR, в которую входят Veillonella spp. увеличивает риск развития бронхиальной астмы в более старшем возрасте [14]. Вейлонеллы относятся к основным резидентным микроорганизмам тонкой кишки, а также к наиболее распространенным и физиологически значимым бактериям толстой кишки человека. Количество (OTU, %) видов Veillonella снижается в микробиоценозе толстой кишки детей после применения КД, их снижение может привести к развитию дисбиоза.
- Увеличение родов и видов* некоторых представителей микробного сообщества после применения кетогенной диеты в микробиоценозе толстой кишки детей: Eggerthella, Eggerthella_lenta*, Corynebacterium, Bilophila, Bacteroides, Parabacteroides, Paraprevotella, Alistipes, Odoribacter, Enterococcus, Porphyromonas, Adlercreutzia, Collinsella, Slackia, Coprococcus, Campylobacter, Klebsiella, Escherichia_coli*. См. диаграмму 1.
Corynebacterium. недифтерийные коринебактерии: Corynebacterium pseudodiphtheriticum, Corynebacterium xerosis, Сorynebacterium riegelii, Corynebacterium striatum и иные, являющиеся условно-патогенными микроорганизмами, колонизирующие кожу и слизистые оболочки человека, иногда выделяются от пациентов с острыми заболеваниями верхних дыхательных путей, гнойно-септическими процессами, патологией урогенитального тракта и т.д. В зависимости от биологических особенностей разные виды коринебактерий способны поражать кожу и внутренние органы, особенно у пожилых людей, пациентов с иммуносупрессией или мультиорганной патологией. Многие представители коринебактерий становятся причиной эндокардитов, пневмоний, септического артрита и остеомиелита, инфекций при протезировании, заболеваний мочеполовой системы. - Бактерии из рода Corynebacterium были изолированы из почвы, сточных вод и молочных продуктов. Corynebacterium aurimucosum (штамм ATCC 700975 / DSM 44827 / CN-1) представляет собой грамположительную бактерию, выделенную из здоровых образцов женских мочеполовых путей, и считается частью нормального микробного сообщества. Он был выделен из ряда клинических образцов, включая кровь и костную ткань (остеомиелит), однако неизвестно, какую роль этот организм может играть в развитии патологий.
- Eggerthella (E.lenta). Этот микроб является протеолитическим, в процессе ферментации выделяет: водород, формиат, лактат, Н2S. Виды Eggerthella обнаруживаются в толстой кишке и кале человека и являются причиной язвенного колита , абсцессов печени и анального канала и системной бактериемии [16]. Бактерии вида Eggerthella lenta были выделены из ряда абсцессов, из тканей аппендикса, перитонеальной жидкости и опухолей кишечника. Они часто участвует в смешанных инфекциях с другими бактериями. Трудности в выращивании и идентификации, вероятно, являются причиной того, что о инфекциях, вызванных Eggerthella, сообщается крайне редко (Saunders E. at al.). Увеличение бактерий Eggerthella это очень плохо.
- Bilophila (B. wadsworthia) условно-патогенные, устойчивые к желчи и бета-лактамным антибиотикам бактерии с несколькими патогенными факторами, такими как образование абсцессов, выделение эндотоксина, цитотоксичность и клеточная адгезия, а также белки наружной мембраны [26]. Бактерия осуществляет ферментацию в кишечнике с использованием таурина в качестве конечного акцептора электронов. B. wadsworthia тесно связана с видами Desulfovibrio и Lawsonia intracellularis, которые считаются патогенами толстой кишки. Вид B. wadsworthia чаще всего ассоциируется с аппендицитом, холециститом, отитом и перитонитом и повышает риск заболевания раздраженной кишки (ВЗК) [24, 25]. При ВЗК хроническое воспаление толстой кишки вызывает судороги, диарею и потерю веса. Считается, что одним из факторов увеличения заболеваемости ВЗК является увеличение потребления жирных, обработанных пищевых продуктов, которые стимулируют рост B. Wadsworthia, за счет увеличения таурохолевой желчной кислоты, вызывающей колит [23].
- Alistipes бактерии данного рода должны присутствовать в кишечнике в ограниченных количествах. Диета обедненная клетчаткой увеличивает количество представителей рода Alistipes [18]. Некоторые виды Alistipes обнаруживаются в очень большом количестве в микробиоценозе толстого кишечника детей с РАС [19]. Другие исследования продемонстрировали обратную связь между высоким ИМТ и обилием Alistipes в кишечнике [20]. Также было показано, что обилие Alistipes в кишечнике снижается у людей с воспалительным заболеванием кишечника, язвенным колитом и болезнью Крона. Высокая распространенность представительей данного рода также связана с СРК у детей [17]. Увеличение этой бактерии на фоне снижения представителей нормобиоценоза и основных продуцентов SCFA, приводит к жесткому дисбиозу и развитию патологических процессов в организме хозяина.
- Enterococcus. Энтерококки осуществляют метаболизм бродильного типа, ферментируют разнообразные углеводы с образованием в основном молочной кислоты, без образования газа, снижая кислотность среды до 4,2–4,6 pH. Энтерококки E. faecium колонизируют преимущественно тонкую кишку. Они обладают высокой ферментативной активностью, выраженным антагонизмом по отношению к условно-патогенным микробам (вырабатывают энтероцины), выживают в желчи. Enterococcus faecium также является условно-патогенным микробом [32]. С одной стороны, этот микроорганизм необходим для человека (в опытах на животных было доказано, что отсутствие Enterococcus faecium в кишечнике может привести к гибели животного от инфекции), но, с другой, может быть причиной различных заболеваний. Enterococcus faecium могут быть причиной спонтанного бактериального перитонита. Enterococcus faecalis - фекальный энтерококк может являться возбудителем различных инфекций: мочевыводящих путей, интраабдоминальных, органов малого таза, раневых, эндокардита [32]. Фекальные энтерококки, наряду с энтерококками вида фэциум являются наиболее патогенными видами среди энтерококков, они составляют 80–90% от всех выделенных в клиническом материале человека энтерококков. Фекальные энтерококки часто бывают причиной внутрибольничных инфекций.
- Odoribacter (O. splanchnicus). Представители этого рода являются оппортунистическими патогенами. Первоначально O. splanchnicus были выделены из брюшного абсцесса в организме человека и классифицировались как Bacteroides splanchnicus. Члены Odoribacter sp. могут вызвать различные патологии, например, брюшной абсцесс у людей и заболевания пародонта у домашних животных. С другой стороны, уменьшение численности Odoribacter sp. приводит к снижению доступности SCFA, что приводит к риску развития ВЗК [21]. Так же, показано, что их наличие в кишечнике в небольшом количестве полезно для профилактики ряда заболеваний, таких как гипертония [21]. В исследование 2016 года, где применялся метформин для лечения СД 2, была обнаружена отрицательная корреляция между обилием видов Odoribacter и концентрацией глюкозы в крови у мышей [22]. Таким образом, они классифицируются как атипичные патогены.
Вот тут немного отдохнем…и снова в бой!
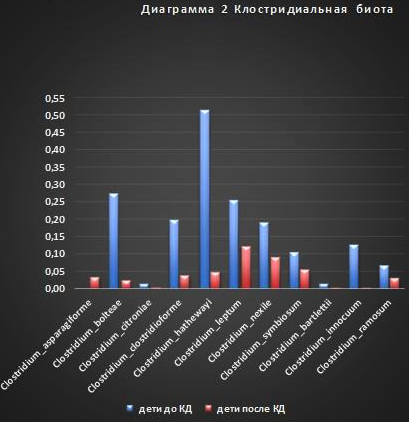 Особое значение при эпилепсии и РАС имеют клостридиальные виды микроорганизмов [27, 28, 29, 30]. Рассмотрим более подробно виды клостридий, которые были изменены в микробном сообществе детей после применения КД в данном исследовании. См. диаграмму 2.
Особое значение при эпилепсии и РАС имеют клостридиальные виды микроорганизмов [27, 28, 29, 30]. Рассмотрим более подробно виды клостридий, которые были изменены в микробном сообществе детей после применения КД в данном исследовании. См. диаграмму 2.
Из выявленных 11 видов клостридий в фекальной микробиоте детей после применения КД снизилось количество генов OTU 10 клостридиальных видов (см. диаграмму 2): Clostridium_bolteae, Clostridium_citroniae, Clostridium_clostridioforme, Clostridium_hathewayi, Clostridium_leptum, Clostridium_nexile, Clostridium_symbiosum, Clostridium_bartlettii, Clostridium_innocuum, Clostridium_ramosum. Особенностью клостридий является выработка токсинов и симптомы, связанные с ними, то есть клостридиозные токсикоинфекции. Токсинообразование – это фактор патогенности клостридий. Некоторые виды клостридий (C. botulinum, C. tetani, C. perfringens) продуцируют одни из самых сильных бактериальных экзотоксинов (ботулотоксин, столбнячный токсин – тетаноспазмин, ε-токсин, разрушающий эритроциты). Экзотоксины обладают нейротоксичностью и гемотоксичностью, некротоксичностью [31]. Другим фактором патогенности является инвазивность – способность локального повреждения тканей за счет выработки ряда протеолитических ферментов. В частности, C. perfringens способна вырабатывать расщепляющую белки протеиназу, коллагеназу, гиалуронидазу. Главной особенностью патогенного действия клостридий является преобладание некротических процессов в тканях над воспалительными процессами. Жизнедеятельность клостридий осуществляется в анаэробных условиях и сопровождается выработкой токсинов, ферментов и белков, которые способствуют газообразованию и некрозу в тканях, развитию общей токсикоинфекции, чаще всего нейротоксического характера. Единственный вид клостридий, количество которых увеличилось у детей после применения КД - Clostridium_asparagiforme. Данная бактерия производит ацетат, лактат и этанол в качестве основных продуктов ферментации глюкозы. Также продуцирует фермент EC 4.3.1.20, который катализирует углерод-азотные соединения до оксалоацетата и NH3, роль данного фермента до конца не изучена. Очень важным является тот факт, что C. asparagiforme содержат пептид, который, активирует Т-клетки-киллеры, которые являются естественным компонентом иммунной системы человека, для нацеливания и фиксации на бета-клетки поджелудочной железы, что приводит к апоптозу бета-клеток и соответственно к уменьшению выработки инсулина. Т.е. данная бактерия принимает участие в развитии патологии СД 1 типа [6].
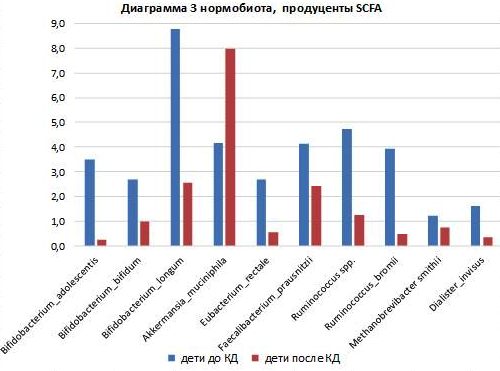 В микробиоценозе детей после применения КД обнаружено уменьшение количества видов представителей нормобиоценоза, продуцентов SCFA, положительно влияющих на гомеостаз макроорганизма: Bifidobacterium, Eubacterium, Eubacterium_rectale* Faecalibacterium_prausnitzii*, Propionibacterium_freudenreichii*, Akkermansia_muciniphila* Lactobacillus, Streptococcus_salivarius*, Streptococcus_thermophilus*, Methanobrevibacter smithii*, Dialister_invisus*. См. диаграммы 3 и 4.
В микробиоценозе детей после применения КД обнаружено уменьшение количества видов представителей нормобиоценоза, продуцентов SCFA, положительно влияющих на гомеостаз макроорганизма: Bifidobacterium, Eubacterium, Eubacterium_rectale* Faecalibacterium_prausnitzii*, Propionibacterium_freudenreichii*, Akkermansia_muciniphila* Lactobacillus, Streptococcus_salivarius*, Streptococcus_thermophilus*, Methanobrevibacter smithii*, Dialister_invisus*. См. диаграммы 3 и 4.
Все эти представители микробного сообщества являются резидентными микроорганизмами, продуцирующими SCFA, они входят в «ядро микробиоценоза», т.е. это те виды, без которых невозможен нормальный гомеостаз микробного сообщества кишечника. В некоторых исследованиях подтверждаются выводы об уменьшении относительной численности Bifidobacterium и E. rectale в рационе с низким содержанием углеводов, что приводит к снижению производства ацетата и лактата [33, 35]. Ацетат и лактат являются продуктами гликолиза Bifidobacterium [34]. Обе кислоты способствуют снижению рН в кишечнике, что предотвращает рост патогенных микроорганизмов.
В микробиоценозе детей после применения КД обнаружено увеличение только 2 видов гликолитических бактерий, продуцирующих SCFA: Roseburia_hominis, Roseburia_intestinalis, однако количество Roseburia_inulinivorans уменьшилось после применения КД. Масляная кислота и её производные, бутираты, играют важную роль в поддержании кишечного гомеостаза, являются основным энергетическим материалом для эпителиоцитов толстой кишки и предотвращают развитие различных заболеваний кишечника. Так, бутират стимулирует выработку MUC2 бокаловидными клетками кишечника, что способствует поддержанию и нормальному функционированию кишечного эпителия [36].
Заключение.
- Во многих исследованиях показано положительное влияние КД на такие патологические состояния как эпилепсия, РАС и некоторые аутоиммунные заболевания. Возможно, при данных патологиях, кишечная микробиота играет особое значение, что подтверждается улучшением симптоматики и общего состояния пациентов при использовании антибиотикотерапии и КД.
- Однако, большинство исследований подтверждает то, что КД ухудшает кишечный микробиоценоз человека. Микробиоценоз ухудшается, а состояние улучшается? Парадокс или апория? Дело в том, что микробиоценоз при аутоиммунных заболеваниях, РАС, эпилепсии, уже нарушен, наблюдается СИБР, повышенная кишечная проницаемость, увеличение многих аллохтонных микроорганизмов, транзиторов. При этих состояниях КД, подобно антибиотикотерапии, положительно влияет на микробиоценоз, она модулирует микробное сообщество таким образом, что уменьшается количество бактериальных родов и видов в кишечнике как индигенных так и транзиторных. СИБР прекращается, восстанавливается нормальная функция кишечного эпителия. Это то что необходимо при данных патологиях.
- Но если рассматривать КД как постоянную диету, как «образ жизни», при длительном ее использовании, она ухудшает микробиоценоз до критического состояния, таким образом, что после снижения общей бактериальной нагрузки начинает развиваться взамен автохтонной микробиоты - сопутствующая, факультативная микробиота за счет деградации собственного кишечного муцина. Создаются бактериальные биопленки теми видами микроорганизмов, которые не должны присутствовать в преобладающем количестве. Они захватывают экологическую нишу и становятся там главными. В настоящее время разработаны способы разрушения бактериальных биопленок, применение современных антибиотиков и веществ деградантов позволяет справиться с этой проблемой, однако мало что известно о полной структуре и функциональности микробиоценоза кишечника человека. С каждым годом открываются все новые и новые неизвестные виды и даже рода микроорганизмов. Разрушив старое, очень сложно создать качественное новое. И в этом вся загвоздка. Фекальная трансплантация прекрасно продемонстрировала свои положительные эффекты не только при воспалительных заболеваниях кишечника и энтероколитах, но и аутоиммунных патологиях. Однако, при этом есть неблагоприятные исходы, не приживаемость трансплантантной микробиоты и смертельные случаи.
- Микробиоценоз это огромная живая система, которая находиться в симбиозе с человеком, точно так же, как и человек должен находиться в «симбиозе» с природой, планетой. Еще более 300 лет назад можно было сказать - Берегите себя, сейчас же я скажу - Берегите себя и своих бактерий!
Литература:
1. https://www.facebook.com/permalink.php?story_fbid=633580127093682&id=100013251018488
2. Ссылка на прошлое исследование, где описываются некоторые бактериальные рода и виды (см. 4 пункт - Бактерии в кишечнике) https://www.facebook.com/permalink.php?story_fbid=451623985289298&id=100013251018488
3. Wang T., Cai G., Qiu Y. et al. Structural segregation of gut microbiota between colorectal cancer patients and healthy volunteers. ISME J. 2012; 6: 320–329.
4. Loubinoux, J., Bronowicki, J., Pereira, I. A. C., et al. (2002). Sulfate- reducing bacteria in human feces and their association with inflammatory bowel diseases. FEMS Microbiology Ecology, 40, 107–112
5. Jeong ock JooJin-Ha ChoiIn Hwa Kim, et al. Effective bioremediation of Cadmium (II), nickel (II), and chromium (VI) in a marine environment by using Desulfovibrio desulfuricans. Biotechnology and Bioprocess Engineering. Sept. 2015, Volume 20, Issue 5, pp 937–941
6. Cole DK, Bulek AM, Dolton G, et al. Hotspot autoimmune T cell receptor binding underlies pathogen and insulin peptide cross-reactivity. J Clin Invest. 2016 Sep; 126(9):3626).
7. Chu YW, Wong CH, Chu MY, Cheung CPF, Cheung TKM, Tse C, Luk WK, Lo JYC. 2009. Varibaculum cambriense infections in Hong Kong, China, 2006. Emerg Infect Dis 15:1137–1139.
8. Bradshaw C. S., Tabrizi S. N., Fairley C. K., et al. The association of Atopobium vaginae and Gardnerella vaginalis with bacterial vaginosis and recurrence after oral metronidazole therapy. The Journal of Infectious Diseases, Vol. 194, Iss. 6, 15 Sept. 2006, Pp. 828–836.
9. Polatti F. Bacterial vaginosis, Atopobium vaginae and nifuratel. Curr. Clin. Pharmacol. 2012 Feb 1;7(1):36-40.
10. Würdemann D., Tindall B. J., Pukall R, et al. Gordonibacter pamelaeae gen. nov., sp. nov., a new member of the Coriobacteriaceae isolated from a patient with Crohn's disease, and reclassification of Eggerthella hongkongensis Lau et al. 2006 as Paraeggerthella hongkongensis gen. nov., comb. nov. 01 June 2009, International Journal of Systematic and Evolutionary Microbiology 59: 1405-1415.
11. Hsiao A, Ahmed AM, Subramanian S, et al. Members of the human gut microbiota involved in recovery from Vibrio cholerae infection. Nature. 2014 Nov 20; 515(7527): 423-6.
12. Shen X.J., Rawls J.F., Randall T. et al. Molecular characterization of mucosal adherent bacteria and associations with colorectal adenomas. Gut Microbes 2010; 1: 138–147.
13. Nagao-Kitamoto H, Kamada N. Host-microbial Cross-talk in Inflammatory Bowel Disease. Immune Netw. 2017 Feb; 17(1): 1-12.
14. Arrieta MC, Stiemsma LT, Dimitriu PA, et al. Early infancy microbial and metabolic alterations affect risk of childhood asthma. Sci Transl Med. 2015 Sep 30; 7(307): 307ra152.
15. Brook, I., and E. H. Frazier. 1992. Infections caused by Veillonella species. Infect. Dis. Clin. Pract. 1:377-381.
16. Lau, S.K.P.; P. C.W. Woo; A. M.Y. Fung; K.M. Chan; G. K.S. Woo; K.Y. Yuen (2004). Anaerobic, non-sporulating, gram-positive bacilli bacteraemia characterized by 16S rRNA gene sequencing. J. Med. Microbiol. 53 (Pt 12): 1247–1253.
17. Saulnier DM1, Riehle K, Mistretta TA, et al. Gastrointestinal microbiome signatures of pediatric patients with irritable bowel syndrome. Gastroenterology. 2011 Nov; 141(5): 1782-91.
18. Claesson M.J., Jeffery I.B., Conde S., et al. Gut microbiota composition correlates with diet and health in the elderly. Nature. 2012; 488: 178–184.
19. De Angelis M1, Piccolo M, Vannini L, Siragusa S, et al. Fecal microbiota and metabolome of children with autism and pervasive developmental disorder not otherwise specified. PLoS One. 2013 Oct 9; 8(10): e76993.
20. Verdam FJ1, Fuentes S, de Jonge C, Zoetendal EG, et al. Human intestinal microbiota composition is associated with local and systemic inflammation in obesity. Obesity (Silver Spring). 2013 Dec; 21(12): E607-15.
21. Gomez-Arango, L. F., Barrett, H., McIntyre, D., et al. Increased Systolic and Diastolic Blood Pressure Is Associated With Altered Gut Microbiota Composition and Butyrate Production in Early Pregnancy. Hypertension. 2016; 68: 974-977.
22. Salomaki-Myftari, H., L. H. Vahartalo, L. Ailanen, S. Pietila, A., et al. Neuropeptide Y overexpressing female and male mice show divergent metabolic but not gut microbial responses to prenatal metformin exposure. PLoS One. 2016; 11: e0163805.
23. Magrone T, Jirillo E. The interaction between gut microbiota and age-related changes in immune function and inflammation. Immun Ageing. 2013 Aug 5; 10(1): 31.
24. Feng Z, Long W, Hao B, et al. A human stool-derived Bilophila wadsworthia strain caused systemic inflammation in specific-pathogen-free mice. Gut Pathog. 2017 Oct 26; 9: 59.
25. Dahmus JD, Kotler DL, Kastenberg DM, Kistler CA. The gut microbiome and colorectal cancer: a review of bacterial pathogenesis. J Gastrointest Oncol. 2018 Aug; 9(4): 769-777.
26. Mochida C, Hirakata Y, Matsuda J, et al. Antimicrobial susceptibility testing of Bilophila wadsworthia isolates submitted for routine laboratory examination. J Clin Microbiol. 1998 Jun; 36(6): 1790-2.
27. Finegold SM, Molitoris D, Song Y, et al. Gastrointestinal microflora studies in late-onset autism. Clinical Infectious Diseases. 2002, 35: S6-S16. 10.1086/341914.
28. Song YL, CX Liu, Finegold SA: Real-time PCR quantitation of clostridia in Feces of autistic children. Applied and Environmental Microbiology. 2004, 70 (11): 6459-6465. 10.1128/AEM.70.11.6459-6465.2004.
29. Parracho HM, Bingham MO, Gibson GR, McCartney AL: Differences between the gut microflora of children with autistic spectrum disorders and that of healthy children. Journal of Medical Microbiology. 2005, 54 (10): 987-991. 10.1099/jmm.0.46101-0.
30. Strati, F.; Cavalieri, D.; Albanese, D.; De Felice, C.; Donati, C.; Hayek, J.; De Filippo, C. New Evidences on the Altered Gut Microbiota in Autism Spectrum Disorders. Microbiome 2017, 5.
31. Janik E, Ceremuga M, Saluk-Bijak J, Bijak M. Biological toxins as the potential tools for bioterrorism. Int J Mol Sci. 2019 Mar 8; 20(5). pii: E1181.
32. Gao W, Howden BP, Stinear TP. Evolution of virulence in Enterococcus faecium, a hospital-adapted opportunistic pathogen. Curr Opin Microbiol. 2018 Feb; 41:76-82.
33. Duncan SH, et al. Reduced dietary intake of carbohydrates by obese subjects results in decreased concentrations of butyrate and butyrate-producing bacteria in feces. Appl. Environ. Microbiol. 2007; 73: 1073–1078.
34. Fukuda S, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate. Nature. 2011; 469: 543–547.
35. Agus A, et al. Western diet induces a shift in microbiota composition enhancing susceptibility to adherent-invasive E. coli infection and intestinal inflammation. Sci. Rep. 2016; 6: 19032.
36. Singh N, et al. Activation of Gpr109a, receptor for niacin and the commensal metabolite butyrate, suppresses colonic inflammation and carcinogenesis. Immunity. 2014; 40: 128–139.
Автор статьи:
Безродный Святослав Леонидович, научный сотрудник лаборатории диагностики и профилактики инфекционных заболеваний ФБУН МНИИ эпидемиологии и микробоилогии им. Г. Н. Габричевского специалист в области микробного сообщества кишечника человека
А какая же диета является здоровой и имеет научное обоснование для продления жизни? - диета OL (смотреть видео).
Обязательно оставляйте свои комментарии под статьей, которую Вы читаете. Это очень важно для нас.
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить. Обязательно оставляйте свои комментарии под статьей, которую вычитаете. Это очень важно для нас.

Автор статьи
Веремеенко Дмитрий Евгеньевич
Телефон:
Почта:
Сфера деятельности - data science в медицине
Основатель проекта, изучающего терапии, направленные на увеличение продолжительности жизни человека (nestarenie.ru/slb-expert_.html)
Со-основатель IT сервиса продления жизни
Основатель форума о продлении жизни Nestarenie Camp (nestarenie.ru/camp.html)
Со-автор книги "Бонусные годы" (nestarenie.ru/kniga-3.html)
Создатель справочного блога о старении человека (nestarenie.ru)
Социальные сети:
- Карта Viza (доллары): 4215 8901 1587 0138 для переводов за пределами РФ
- Карта МИР в Сбере (рубли): 2202 2032 1501 6686 (МАЙЯВИ Ч.) - на территории РФ
Свежие комментарии
Подпишитесь на свежие статьи
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить.
5 комментариев
Понятно, кетодиета хороша без фанатизма. Было бы здорово, получить практические рекомендации по улучшению биоценоза кишечника. Спасибо.
Дмитрий, Вы располагаете информацией о фекальной трансплантации при диабете 1 типа?Если да, то дайте ссылку.Спасибо.
Хотелось бы еще уточнить следующее – исходя из приведенных исследований, КД в долгосрочной перспективе – не благоприятна для микробиоты кишечника. Наилучший результат для здоровья достигнут будет если выбрать другой тип питания? Или возможно придерживаться КД , но с постоянным приемом параллельно пробиотиков, пребиотиков?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Другой тип питания, если для остальных людей, кроме больных эпилепсией.
Несомненно, будет предпочтительней другой тип питания. Кетогенную диету рекомендуется проводить в краткосрочные периоды, желательно в зимнее время, когда холодно. Так же рекомендуется использовать кетогеннуя диета с минимальными концентрациями пероральных антибиотиков широкого спектра действия, но это уже отдельные протоколы для различных людей, пациентов в соответствии с их анализами.