Дата создания: 24 октября 2018
Обновлено: 27 июня 2021
Старение и дряхлость – в чем разница
Думаю нужно определиться с тем, что такое старение. Иначе каждый будет прав. По сути старением можно называть, что угодно. Я, например, склонен на сегодняшний день считать, что старение происходит даже у мертвого. Это то, что мы изменить пока не можем, если банально не заморозим тело. Есть еще и какие-то процессы, которые ускоряют старение внешнее и ускоряют развитие болезней. Но так как на это мы влиять можем, то есть мнение, что это не нужно называть старением. Кто-то называет дряхлостью. Ок. Пусть так. Итак, если стареем все примерно одинаково, то все умрем к 110-120 — спорный момент конечной точки. То есть старение определяет максимальную продолжительность жизни человека. Но к старению добавляется дряхлость, которая обуславливает то, что кто-то умирает раньше, кто-то позже в пределах это максильной продолжительности жизни. То есть благодаря дряхлости возникает средняя продолжительность жизни. Вот в рамках средней продолжительности жизни все наши терапии. Как же повлиять на скорость старения — это главная задача. Но для обывателя пусть все будет старением. Ведь внешне все вроде как старятся по разному. Наша задача сегодня - оставаться внешне и внутренне не дряхлым, здоровым до глубоких лет - где-то до 90-110. И это сегодня возможно. Но старение мы тоже победим. А вообще, что такое старение - здесь.
Сейчас стало очень модно писать про эпигенетический откат. Это прекрасно, что с помощью улучшения эпигенетики мы можем улучшить свое здоровье и пожить подольше. Но эпигенетический откат не омолаживает нас. Потому что он не омолаживает внеклеточный матрикс. В результате такой откат может улучшить здоровье молодых. Но чем старше мы становимся, тем все меньше мы можем откатить эпигенетику. По сути упигенетический откат всего лишь улучшает наше здоровье, продлевает среднюю продолжительность жизни. Но не продлит максимальную. И на мышах такой откат не показал радикального продления. На людях будет примерно так, как на графике снизу.
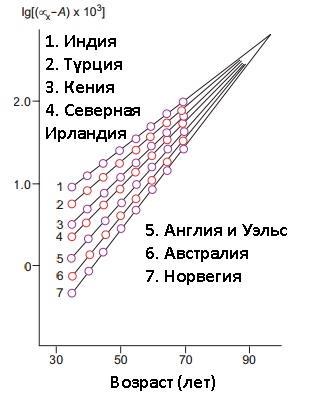 Комментируя данный график, ссылаясь на известное исследования Леонида Гаврилова (если я не ошибаюсь), логично предположить, что если люди живут дольше, то видимо они функционально стареют медленнее. Но это не так. Если анализировать данные из разных стран, то увидим, что скорость функционального старения населения быстрее в тех странах, где выше средняя продолжительность жизни. Так как изначально уровень здоровья в развитых странах выше, но и теряют своё здоровье в этих странах быстрее. В тех странах, где смертность самая низкая - там она быстрее всего растёт. Какое бы здоровье у них не было, но матрикс стареет примерно одинаково и исход у всех один.
Комментируя данный график, ссылаясь на известное исследования Леонида Гаврилова (если я не ошибаюсь), логично предположить, что если люди живут дольше, то видимо они функционально стареют медленнее. Но это не так. Если анализировать данные из разных стран, то увидим, что скорость функционального старения населения быстрее в тех странах, где выше средняя продолжительность жизни. Так как изначально уровень здоровья в развитых странах выше, но и теряют своё здоровье в этих странах быстрее. В тех странах, где смертность самая низкая - там она быстрее всего растёт. Какое бы здоровье у них не было, но матрикс стареет примерно одинаково и исход у всех один.
Предполагаю, что также будет и с эпигенетическим откатом.
Это происходит видимо потому, что старение на уровне матрикса у долгожителей всех стран идёт одинаково во всех странах - независимо от условий жизни. А условия жизни лишь помогают сгладить симптомы старения до какой-то критичной точки - которая у всех одна.
ncbi.nlm.nih.gov/pubmed/12867663
dx.doi.org.sci-hub.cc/10.1126/sageke.2003.28.re5
Обязательно оставляйте свои комментарии под статьей, которую Вы читаете. Это очень важно для нас.
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить. Обязательно оставляйте свои комментарии под статьей, которую вычитаете. Это очень важно для нас.

Автор статьи
Веремеенко Дмитрий Евгеньевич
Телефон:
Почта:
Сфера деятельности - data science в медицине
Основатель проекта, изучающего терапии, направленные на увеличение продолжительности жизни человека (nestarenie.ru/slb-expert_.html)
Со-основатель IT сервиса продления жизни
Основатель форума о продлении жизни Nestarenie Camp (nestarenie.ru/camp.html)
Со-автор книги "Бонусные годы" (nestarenie.ru/kniga-3.html)
Создатель справочного блога о старении человека (nestarenie.ru)
Социальные сети:
- Карта Viza (доллары): 4215 8901 1587 0138 для переводов за пределами РФ
- Карта МИР в Сбере (рубли): 2202 2032 1501 6686 (МАЙЯВИ Ч.) - на территории РФ
Свежие комментарии
Подпишитесь на свежие статьи
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить.
29 комментариев
Читал что если поместить ядро раковой клетки в здоровую цитоплазму,то рака не будет,а если здоровое ядно в раковую цитоплазму ,то возникнет рак….гены находятся в ядре,но как я понял цитоплазма влияет на активность геннов,так пишут в нэте…то бишь рак из-за плохих настрояк которые идут от цитоплазмы
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Это не совсем так. Это лишь при определенных условиях, определенный вид рака.
Дмитрий,хотел спросить насчет лецитина…все его нахваливают в интернете ,но у вас вроде читал, что им можно навредить здоровью…неподскажите чем он вреден?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Читайте здесь
https://nestarenie.ru/nootrop.html
Дмитрий, получается чтобы стать бессмертным, надо будет редактировать геном половых клеток и стволовых ,либо вводить новые без ошибок в днк и удалять старые(имеется ввиду у которых накопились ошибки, но в целом они могут делится),даже если матрикс будет новый…так как эти бессмертные клетки накопили ошибки и приведут к раку хоть и способны дальше делиться
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Нет. Клетки планарий ведь делятся и норм. Стволовые клетки довольно стабильны, если возникают в них мутации опасные, то такие клетки самоуничтожаются
Дмитрий,прочитал что продление жизни за счет теломеразы происходила только при использование генов…а та 65 ,походу либо пустышка, либо не на все клетки действует,либо что-то другое…просто по факту она продлила жизни и значительно(именно генномная, а не индуктор та 65 )потому как он не работает вообще в отличии от генной корректировки…а чтоб избежать рака надо усилить ферменты репарации ДНК и повысить ген p53 и тому подобные…видел исследования в котором сочетали голодание плюс теломераза…удалось продлить на 50% макс продолжительность жизни…надо бы ещё старые удалить и стволовых добавить, может усилится эффект…можно ещё отдалить деление клеток,что уменьшит ошибки и продлит жизнь…читал, что это реально если воздействовать на сигналы приказывающие делится клетки…на счет теломер разных животных и корреляция с продолжительностью жизни,информация интересная,но всё же по факту генная теломераза сработала хорошо…мы так только все можем запутаться,тема сложная…надо смотреть на факты
Читал ещё что в пробирки при добавлении в обычные клетки теломеразы,они становятся бессмертными и рака не возникает….на мышах увеличение теломер теломеразой тоже не увеличило число рака…стволовым клетка надо меньше делится чтоб заменить клетки,которые погибли при пределе деления…и они меньше мутируют
Ещё насчет стволовых клеток…у них очень сильная репарация днк ,поэтому они не так часто мутируют,как должны были…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Не только. Стволовые клетки не так сильно мутируют в том числе из-за особенности деления, а также из-за того, что сильно защищены костями внутри костного мозга от окислительного стресса и защищены от токсинов с помощью P-гликопротеинов или белков множественной лекарственной резистентности. — это белок, который существует у животных и грибов для защиты от вредных веществ — в том числе от лекарств. Именно этот белок мешает лекарствам проявить своё действие в полном масштабе. И даже больше. Некоторые виды раковых опухолей увеличивают уровень белка Р-GP, оказывая, таким образом, устойчивость к лекарственной терапии. И если снять эту защиту, то можно будет сильно снижать дозировки антираковых препаратов, добиваясь того же эффекта. А это очень важно — ведь чем меньшую дозировку мы используем, тем меньше вреда нанесём своему организму этим препаратом en.wikipedia.org/wiki/P-glycoprotein
В том числе, белок P-GP (про который писалось выше в данной статье) защищает гемопоэтические стволовые клетки от токсинов.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Казалось бы, «включение» теломеразы во всех клетках может сделать клетку бессмертной. Однако вскоре возникли опасения в связи с тем, что активный синтез теломеразы наблюдается и в 90% раковых опухолей. Встал вопрос: не приведет ли активация теломеразы к риску злокачественной трансформации? Кроме того, оказалось, что старение клеток далеко не всегда сопровождается сокращением теломер. Например, в случае эпителиальных клеток слизистой полости рта или роговицы глаза человека. Это говорило о том, что активация теломеразы не остановит старение. Перед тем как перейти к генной терапии, эффекты теломеразы исследовались на трансгенных мышах. Оказалось, что если «включить» ген TERT во всех клетках мыши, то увеличивается и риск рака у мышей.
ncbi.nlm.nih.gov/pubmed/12034875
ncbi.nlm.nih.gov/pubmed/27784441
У мужчин теломеры были значительно длиннее, чем у женщин, однако мужчины живут меньше женщин. В данном исследовании не найдено никаких доказательств значимой связь между длиной теломер в возрасте 70 лет и ухудшения памяти, скорость обработки информации в возрасте 70 лет, или когнитивными нарушениями в возрасте от 11 до 70 лет. Нет доказательств связи между длиной теломер измерений физического здоровья. Данное исследование не поддерживает гипотезу о том, что длина теломер является полезным показателем биологического возраста в здоровой пожилой популяции Этоисследование показывает, что длина теломер не является достаточной для того, чтобы быть маркером незначительных различий в когнитивных изменениях в течение жизни между членами относительно здоровой 70 – летней популяции. Когнитивные способности в молодости не предсказывали длину теломер в возрасте 70 лет. Преимущества этого исследования заключались в большой выборке, а также в возрастной, этнической и географической однородности выборки, в наличие когнитивных оценок за 60 лет до этого, в возрасте 11 лет.
ncbi.nlm.nih.gov/pubmed/21194798
Много лет уже пытаются рассматривать теломеры, как биомаркер старения, но до сих пор нет доказательств. Самый свежий обзор 2017 года делает заключение, что длина теломеров лейкоцитов не связана с продолжительность жизни. Физическая активность хорошо ассоциирована с продолжительностью жизни, но связь между физической активностью и длиной теломер не подтверждается в 50% исследований, что также ставит под сомнение ассоциации длины теломеров с продолжительностью жизни людей.
ncbi.nlm.nih.gov/pubmed/29186077
Клетки тетраурелии парамеции имеют ограниченный клональный жизненный период и умирают примерно после 200 делений. Однако их теломеры не сокращаются. После примерно 200 делений в их ДНК накапливается много ошибок и клетка погибает. Поэтому теломеры не могут сделать нас бессмертными.
ncbi.nlm.nih.gov/pubmed/8127914
Чем грозят ошибки в ДНК при бесконечно делящихся ДНК, не ограниченном теломерами? В клетке происходит до 1 000 000 повреждений на клетку в день. Если ремонт не сработал и механизмы самоуничтожения клетки не сработали, то возникают повреждение ДНК – ошибки и мутации (www.ncbi.nlm.nih.gov/pubmed/5055816) (www.ncbi.nlm.nih.gov/pubmed/5106728) В отличии от мышей мы живем гораздо дольше. Тем важнее наши клетки защищать лучше от мутаций. В 107 году в Университете Джона хопкинсона доказали, что 66% всех видом рака у людей случаются в результате случайных мутаций. В отличии от мышей у нас гораздо дольше времени на их возникновение (science.sciencemag.org/content/347/6217/78) Большинство механизмов, которые сильно продлевали жизнь, защищают ДНК от поломок (www.ncbi.nlm.nih.gov/pubmed/15589490). 2016 Токийский медицинский и стоматологический Университет. Старение волосяного фолликула и потеря волос из-за повреждения ДНК в стволовых клетках (www.ncbi.nlm.nih.gov/pubmed/26912707) Генетическая сверх экспрессия BubR1 защищает ДНК, увеличивает максимальную продолжительность жизни трансгенных мышей на 15% и значительно снижает частоту опухолей. Когда экспрессия гена BubR1 снижается, хромосомы не могут правильно разделиться во время митоза. Американские ученые из клиники Майо в Рочестере, штат Миннесота – трансгенные мыши с повышенной экспрессией BubR1. Одна группа мышей подвергалась воздействию веществ, необратимо вызывающих опухоли легких и кожи (www.ncbi.nlm.nih.gov/pubmed/23242215). Генетическая сверх экспрессия MTH1 увеличивает продолжительность жизни у трансгенных мышей на 22% в сравнении с мышами дикого типа. В 2013 год (Италия). Белок MTH1 участвует в ремонте повреждений ДНК и РНК. У мышей геномные повреждения с возрастом накапливались гораздо меньше, так как они живут короче. Поэтому они могут позволить себе немного поудлинять теломеры (www.ncbi.nlm.nih.gov/pubmed/23648059). Активность ядерного фермента PARP1 возрастает в 500 раз и более при связывании с участками разрыва ДНК (ремонтирует ДНК). PARP1 в лейкоцитах клеток коррелирует с МПЖ вида (www.ncbi.nlm.nih.gov/pubmed/1465394). После активации митогеном или антигеном T и B лимфоциты превращаются в лимфобласты. Французские ученые в 1998. В лимфобластах долгожителей (100 лет и старше) значительно выше активности PARP1, чем клеточных линиях молодых людей (от 20 до 70 лет) (www.ncbi.nlm.nih.gov/pubmed/9587069). В клетках пожилых людей (69 до 75 лет) PARP1 и PARP2 уменьшается в 2 раза в сравнении с молодыми (от 19 до 26 лет). Но у долгожителей (от 100 до 107 лет) экспрессия PARP1 на уровне молодых людей (www.ncbi.nlm.nih.gov/pubmed/17518695). Мутации многих генов, которые участвуют в ремонте или метилировании ДНК сильно сокращают жизнь. Ген Ercc1 участвуют в восстановлений повреждений ДНК. Мышей с дефицитом гена Ercc1 (Ercc1∆/-) показывают многочисленные функции ускоренного старения. Сокращение калорий на 30% у таких мышей продлевает жизнь в 3 раза (www.ncbi.nlm.nih.gov/pubmed/27556946). Долгожители от 100 до 107 лет – более высокие ферменты ремонта ДНК (PARP1 и Ku70) чем у (69 до 75 лет). Мыши Ku70 -/- быстро стареют и умирают (www.ncbi.nlm.nih.gov/pubmed/21600302)(www.ncbi.nlm.nih.gov/pubmed/17518695) (www.ncbi.nlm.nih.gov/pmc/articles/PMC2169178). Канада 2003 год. Люди с синдромом Вернера (прогерея взрослых) быстро стареют и имеют дефицит PARP1 (www.ncbi.nlm.nih.gov/pubmed/12707040). Мыши с мутацией Ku70 имеют больше мутаций в ДНК и сильно меньше живут (www.ncbi.nlm.nih.gov/pubmed/10485901) (www.ncbi.nlm.nih.gov/pubmed/16439206) 2011 год, Университет Ливерпуля, Великобритания.
Накопление повреждений ДНК с возрастом является важной причиной старения. А Генетические манипуляции с путями репарации ДНК у мышей, еще более укрепляют эту гипотезу. У человека и других млекопитающих, повреждение ДНК происходит от 25 до 115 раз в минуту в каждой клетке (www.ncbi.nlm.nih.gov/pubmed/21600302) (www.ncbi.nlm.nih.gov/pubmed/10792040). И в связи с эти напомню, что лимит Хейфлика является проявлением механизма, возникшего у многоклеточных организмов для защиты от мутаций. Чтобы на место старых потенциально мутантных клеток рождались новые из стволовых клеток организма. Иначе организм просто погибнет. При каждом делении клеток происходит репликация ДНК, что повышает количество соматических мутаций. Одна мутантная клетка должна дать миллионы потомков, чтобы редкие мутационные события встретились в опасном сочетании. Если просчитать вероятность накопления критического количества мутации, то у человека получается примерно 20-40 клеточных делений на одну мутацию. Одной клетке требуется примерно от 4 до 6 мутаций для превращения в раковую. Таким образом ограничения общего количества делений до 100 достаточно, чтобы предотвратить появление раковых клеток. В результате эволюции наши предки лишь немногие жили дольше 30-40 лет из-за болезней и давления хищников. В результате эволюция нашла баланс между заменой клеток и пролиферацией. Это привело к ограничению числа деления клеток на уровне 50-80 для фибробластов в культуре клеток, что соответствует возрасту 40 лет без лишнего запаса делений.
Когда ДНК мутирует, то она все хуже работает. Повреждения копятся. Такую клетку нужно заменить на новую. Поэтому теломер “говорит” стоп, пора умирать и дать место новой клетке, рожденной из стволовой. Но если теломеры более длинные, то мутации в ДНК копятся больше, и теоретически клетка должна становиться старее. И действительно – на сегодняшний день золотым стандартом скорости старения являются эпигенетические часы Хорвата, основанные на оценке метилирования. Исследователи из нескольких учреждений, включая UCLA, Бостонский Университет, Стэнфордский университет и Институт исследований старения на иврите SeniorLife, проанализировали образцы крови из почти 10 000 человек. Генетические маркеры в гене, ответственном за сохранение теломеров, не связаны с более молодым биологическим возрастом людей. (Мое примечение: люди не крысы, Если бы все дело было в теломерах, то крысы жили бы в 60 раз дольше людей, так как их теломеры в два раза длиннее). И вот, варианты в гене TERT на хромосоме 5, которые связаны с более старым эпигенетическим возрастом, также были связаны с более длинными теломерами. Это указывает на критическую роль гена TERT в регулировании эпигенетических часов. Вывод. Не смотря на то, что крысы с чуть-чуть более длинными теломерами, удлиненными в позднем возрасте, могут прожить немного дольше, но при этом они похоже быстрее эпигенетически стареют.
eurekalert.org/pub_releases/2018-02/hsif-gwa020218.php
Надо ещё учитывать скорость укорочения теломер…животное с длинным теломер может жить мало из-за высокой скорости укорочения,а не из-за длинных теломер
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Учитывается не какие теломеры были, когда родились животные, а теломеры на разных этапах жизни.
Дмитрий,а почему половые,стволовые клетки делятся бесканечно без мутаций и рака?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Почему же без мутаций. Если половая клетка станет раковой – она не сможет зачать ребенка. Если клетка будет с мутацией, то ребенок рождается с дефектом или вообще не выживает. Все работает. Что касается стволовых, то до определенного возраста они, если раковые, то быстро самоуничтожаются. Но после определенного возраста часть стволовых клеток, которые вызывали это самоуничтожение раковых, исчерпывается и начинают выживать раковые стволовые клетки. Вот тогда и рак начинается. Сильно повышается окислительный стресс от старых стволовых ниш, и ДНК стволовых клеток начинают повреждаться. Их становится все меньше и меньше. Часто в возрасте 90 лет все новые клетки крови делает уже всего одна стволовая клетка вместо 2000, которая если погибнет, то и смерть человеку.
Дмитрий,а почему у некоторых животных длинные теломеры в клетках,или много теломеразы,но рак у них бывает не чаще чем у других…то бишь клетки делятся большее количество раз,мутаций должно быть больше…но клетки болеют раком не чаще
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Прогрессивное укорочение теломер на самом деле обеспечивает барьер для прогрессирования опухоли у человека. Исследования показывают (при сравнении около 60 видов млекопитающих, что чем длиннее теломеры у вида, тем быстрее накапливаются у него мутации, больше онкологии и короче продолжительность жизни). Длина теломер обратно коррелирует с продолжительностью жизни.
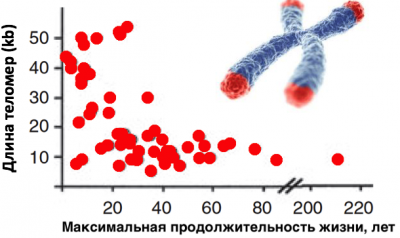
ncbi.nlm.nih.gov/pubmed/21518243
Но у некоторых кроме теломер могут быть другие механизмы защиты от рака. Например, у голого слепыша в раковых клетках синтезирутеся интерферон бета, который уничтожает раковую опухоль. Тем не менее длинные теломеры не только риски рака повышают, но и риски других мутаций, которые могут сокращать жизнь не из-за рака
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Сергей. Ваши доводы неверны. Вы пишите
“Теломераза выключена в обычных клетках для защиты от деления раковых клеток. Но раковые клетки находят способы ее включения и продолжают делиться.”
Сама по себе выключенная теломераза на защищает от раковых клеток. Выключение теломеразы позволяет теломерам сокращаться. Ограничение делений клеток из-за сокращения теломер позволяет защитить клетки от накопления мутаций. Так как при каждом делении клеток мутаций все больше и больше. И когда их становится критически много – клетки могут стать раковыми. Теломеры защищают от такого накопления мутаций, выключая деление клетки после определенного количества мутаций. Но это не страшно. Потому, даже если все теломеры всех наших клеток сократятся и клетки начнут гибнуть – им на смену придут новые клетки, рожденные нашими стволовыми клетками, которые делятся сколько угодно, так как их теломеры не сокращаются. В итоге заботиться о длине теломер не имеет смысла.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Вы пишите: — есть ли исследования подтверждающие, что частота мутаций при каждом делении не зависит от длины теломер? и что вероятность рака зависит только от количества делений?
Мой ответ: Читайте лучший учебник по генетике “Гены по Льюину” – там все есть.
Вы пишите: Клетки могут стать раковыми в любой момент, но в озвученной мной версии именно длинные теломеры дают дополнительную защиту.
Мой ответ: забудем на минуту от том, что ваш вариант не получится на практике. Предположим получится. Тогда накопление мутаций приведет не вк раку, а к старению от других причин. Мутации не только онкологией страшны, а огомным списком проблем, которые даже представить сложно. Могу бесконечно приводить ссылки, но не буду из-за экономии времени. Почитайте “Гены по Льюину”. Там есть все и очень подробно.
Вы пишите: На данный момент известно что в старом организме человека теломеры короткие.
В биологии есть много исследований в которых животные преспокойно себе жили, когда теломеры у них сократились. И никаких проблем. Пока внеклеточный матрикс молодой теломеры не сокращаются. Потому, что на смену старым клеткам исправно стволовые клетки дают новые клетки. Когда межклеточный матрикс стареет, то стволовые клетки начинают погибать и уже значительно реже производят новые клетки. Теломеры в клетках организма сокращаются. Исследования на хвостах крыс показывает, что если крыса перестала расти, то теломеры в клетках хвоста сокращаются. Но если простимулировать рост хвоста крысы, повреждения внеклеточного матрикса хвоста разбавляются при росте хвоста в длину, а теломеры опять восстанавливаются только потому, что стволовые клетки дают новые клетки. Поэтому теломеры – это всего следствие. К тому же их длина очень плохо коррелирует с биологическим возрастом, и ни в одном исследовании никакое стимулирование роста теломер не делало животных нестареющими. ОНи все равно старели и умирали. При чем в разных исследованиях по разному. Где-то раньше контрольной группы, где-то позже. На всех научных конференциях где я бываю теломеры уже предмет насмешек. И ни один известный ученый уже давно не считает это причиной старения.
Дмитрий подскажите,читал что если в новый матрикс поместить старую клетку,то она омолодится…допустим у нас есть клетка которая много раз поделилась и у нею теломеры уже короткие и есть мутации,то есть в новом матриксе теломеры удлинятся и уменьшится количество мутаций?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Нет. Не так. Омолаживаются стволовые клетки, а именно они поставляют новые клетки в организм на место новых. И у стволовых клеток плюрипотентных не сокращаются теломеры, они делятся иначе и они хранятся хорошо и хорошо защищены. Простые же клетки нельзя так защитить. Например, стволовые клетки спрятаны в костный мозг внутри костей и защищены различными механизмами от воздействия на них. Наши же клетки выполняют разные функции – поэтому постоянно повреждаются. Стволовые клетки не выполняют никаких функций, кроме производства новых клеток. Так клетки кожи, а также все эпителиальные клетки сильно контактируют с внешней средой и подвергаются постоянному окислительному стрессу.
В природе существует единственный механизм – который побеждает старение, это зачатие. Старая яйцеклетка и неидеальный сперматозоид из уже поживших семенников (кстати, у сперматозоида почти нет цитоплазмы – он до предела уплотнён для как можно меньшего размера) – формируют с нуля новый матрикс и он их в итоге и омолаживает до нуля.
А вот потом матрикс выделяют фибропласты, которые уже сами находятся в немолодом матриксе, а также выделяемый ими матрикс попадает в уже существующий немолодой. И видимо немолодой матрикс с сшивками сигнальным путём старит вновь прибывший относительно молодой (также как старые клетки своими сигналами старят окружающие их молодые). Вот поэтому все эти процедуры пилинга в косметологии – имеют лишь короткий временный характер омоложения.
Думаю, пока не научимся разрушать сшивки по всему телу до одномоментного значительного уровня их разрушения или хотя бы останавливать накопление сшивок во всём теле с возрастом – радикального продления жизни не будет.
Спасибо, Дмитрий!
А что такое “внеклеточный матрикс”? Он из чего?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
http://nestarenie.ru/matriks.html
Исход у всех один, это понятно, но тем не менее, быть развалиной и умереть в 58лет не так заманчиво нежели в 79 и при неплохом самочувствии.
-Дмитрий, а за счет чего в развитых странах люди теряют своё здоровье быстрее? Тем более, что матрикс стареет примерно одинаково у всех? Что значит здоровье?
Кстати, приведенная в конце статьи ссылка: ncbi.nlm.nih.gov/pubmed/12867663
dx.doi.org.sci-hub.cc/10.1126/sageke.2003.28.re5 к сожалению не работает.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
В развитых странах просто сохраняют здоровье дольше, поэтому к концу жизни теряют быстрее, тогда как в развивающихся странах здоровье плохое долгий период жизни
>> Кстати, приведенная в конце статьи ссылка … к сожалению не работает.
Это не одна ссылка, а две разных (хоть и на одно исследование). Первая – вполне себе работает – попробуйте в другом браузере, или обновите страницу. А вторая – это на ведь на скай-хаб – они периодически меняют домены из-за блокировок. Сейчас вторая ссылка доступна вот на этом домене: sci-hub.tw/http://dx.doi.org/10.1126/sageke.2003.28.re5
Прочитал, что Метиленовый синий хорошо влияет на фибробласты и продлевает жизнь мышам
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Метиленовый синий не продлевает жизнь мышам.