Дата создания: 22 октября 2019
Обновлено: 12 февраля 2023
Вся правда об эпигенетике и старении. Часть I. Эпигенетическое омоложение
В последнее время в биологии старения наблюдается бум исследований, связанных с эпигенетикой. Это и эпигенетические часы, и даже эпигенетическое омоложение!
 И кажется, что уже близка победа над старением, но так ли это на самом деле? Давайте вооружимся критическим мышлением и попробуем разобраться. Начнем, пожалуй, с эпигенетического “омоложения” или как его еще называют “эпиотката”. В чем суть: команда Хуана Исписуа Бельмонте взяла прогерийных мышей и генетически модифицировала их
И кажется, что уже близка победа над старением, но так ли это на самом деле? Давайте вооружимся критическим мышлением и попробуем разобраться. Начнем, пожалуй, с эпигенетического “омоложения” или как его еще называют “эпиотката”. В чем суть: команда Хуана Исписуа Бельмонте взяла прогерийных мышей и генетически модифицировала их
ncbi.nlm.nih.gov/pmc/articles/PMC5679279
В их геном была встроена кассета с факторами Яманаки, которая активировалась доксициклином. Причем Бельмонте подобрал такой режим приема доксициклина, что факторы Яманаки не превращали клетки в стволовые (тем самым предотвращая развитие тератом), а только “омолаживали” их. Так называемое “частичное репрограммирование”. Это позволило продлить продолжительность жизни (ПЖ) таким мышам на величину от 33% до 50%.
Впечатляет, не правда ли? Да, но лишь на первый взгляд. Во-первых, серьезное увеличение ПЖ прогерийным мышам далеко не новость. Например, рапамицин продлевал медианную ПЖ
stm.sciencemag.org/content/4/144/144ra103.full
примерно на 50% мышам с похожей прогерией (тоже ламинопатия). Однако мышам с нормальной ПЖ при помощи рапамицина удалось продлить
onlinelibrary.wiley.com/doi/full/10.1111/acel.12194
медианную продолжительность жизни всего лишь на 26% (это максимальное значение из всех результатов).
 А вот ограничение калорийности (CR) удвоило
А вот ограничение калорийности (CR) удвоило
nature.com/articles/nature19329
Ж короткоживущим мышам с делецией гена Ercc1, который отвечает за репарацию ДНК. И эти мыши жили даже дольше LAKI-мышей в эксперименте Бельмонте. Но обычным мышам CR продлевало жизнь максимум лишь на 40%.
Более того, даже диета с высоким содержанием жиров практически удвоила
onlinelibrary.wiley.com/doi/full/10.1111/acel.12852
ПЖ мышей с прогерией Хатчинсона-Гилфорда. И при этом нужно ли говорить, что продлить ПЖ обычным мышам эта диета вряд ли способна?
Таким образом, из результатов, полученных на прогерийных мышах, не следует, что такие же результаты будут на мышах с нормальной ПЖ. Скорее всего, результаты будут намного меньше, а то и вовсе отсутствовать (как в случае с диетой с высоким содержанием жиров).
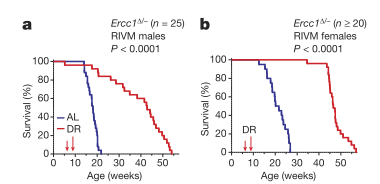
Но нас также интересует и другой вопрос: а было ли омоложение? Вообще, что означает это слово? Как это выглядит на кривой дожития? Поскольку нас интересует в первую очередь продолжительность жизни, то омоложение — это снижение вероятности умереть до уровня молодых, соответственно. А это значит, что кривая дожития долгое время после омоложения должна оставаться горизонтальной поскольку популяция в молодом возрасте почти не вымирает.
Видим ли мы такое в случае эпигенетического омоложения? Давайте взглянем на график (красные и синие кривые):
Все продление жизни здесь происходит с 12 по 19 неделю, а дальше очевидно эпигенетическая терапия не работает, так как кривая стремительно уходит вниз, что означает, что вероятность смерти только растет. А если было бы омоложение (падала бы вероятность смерти до уровня молодых), то мы бы видели длинные горизонтальные отрезки подобные тому, что я выделил зеленым.
Примечание: красная кривая — это тоже генетически модифицированные мыши, но им не активировали факторы Яманаки доксициклином. Тем не менее, небольшое продление жизни есть — это связано, по-видимому, с небольшой фоновой экспрессией факторов Яманаки даже в отсутствие вещества-активатора. Но на результат наших умозаключений это не влияет — так как доксициклин, по-идее, должен запускать полноценное, мощное омоложение, а его в возрасте старше 19 недель попросту нет, так как кривые практически параллельны.
Что же мы имеем в итоге? Никакого омоложения продемонстрировано не было — мы видим лишь некоторую отсрочку, причем отсрочку прогерии, а не старения. Помимо отсутствия омоложения, отсутствуют также какие-либо рекордные цифры продления ПЖ. Более того, эти цифры могут сильно уменьшится при тестировании на мышах с нормальной ПЖ или вовсе превратиться в пшик.
Означает ли это, что подход надо предать забвению? Нет, не означает, так как есть пусть и небольшой, но шанс, что на нормальных мышах эпигенетическое омоложение сработает лучше чем на прогерийных. Но пока нет никаких оснований заявлять, что есть экспериментальные свидетельства превосходства эпигенетического омоложения над имеющимися интервенциями по продлению жизни. А, к сожалению, даже сильнейшее из них — Caloric Restriction — не показало приемлемых результатов на приматах.
Я призываю воспроизвести результаты Бельмонте, но на мышах с нормальной продолжительностью жизни. Но до тех пор давайте оставаться честны сами с собой: никакого омоложения пока, к сожалению, не продемонстрировано (слова автора этой статьи Александра Фединцева) (Александр Фединцев - работал в НИИ Антимикробной химиотерапии. Сейчас инженер систем машинного обучения. Ученый-биогеронтолог, специализирующийся на биостатистике и анализе данных)
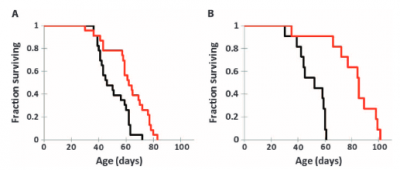
UPD: в эксперименте Бельмонте мышам давали доксициклин в течении 2 дней каждую неделю. Таким образом, у мышей было всего 5 дней, чтобы “постареть”. За 5 дней даже у прогерийных мышей вероятность смерти существенно не вырастет. Значит, если терапия действительно бы омолаживала, то мыши бы абсолютно не старели, а кривая дожития нестареющих организмов выглядит вот так, как на картинке слева.
Статья написана Александром Фединцевым. Вот ссылка на оригинал [https://medium.com/reminder-magazine/вся-правда-об-эпигенетике-и-старении-9e346fa823d9]. Александр Фединцев - работал в НИИ Антимикробной химиотерапии. Сейчас инженер систем машинного обучения. Ученый-биогеронтолог, специализирующийся на биостатистике и анализе данных). Это один из самых правильных ученых в области старения, которых я знаю. Если вы хотите и дальше читать его статьи и узнать продолжение этой статьи, которое он скоро, вероятно, напишет, поддержите автора переходом по ссылке на оригинал его статьи [https://medium.com/reminder-magazine/вся-правда-об-эпигенетике-и-старении-9e346fa823d9]. Ваш интерес будет вознагражден самыми честными и интересными статьями о том, что такое старение и о разоблачении различных мифов в этой области.
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить.
 Автор статьи — Веремеенко Дмитрий Евгеньевич, основатель исследовательского проекта, изучающего терапии, направленные на увеличение продолжительности жизни человека "Лаборатория Экспертных Исследований Тераностика_про" (nestarenie.ru/slb-expert_.html), создатель экспертной системы Тераностика_про, основатель Nestarenie Camp (https://nestareniecamp.ru), со-основатель on-line курса Nestarenie, автор книги "Диагностика старения" (https://nestarenie.ru/Diagnostika.pdf), и со-автор книги "Как дожить до 22 века" (http://book.hostenko.com), создатель блога https://nestarenie.ru, Тел. +7 925 9244328 Dmitriy-tae@yandex.ru
Автор статьи — Веремеенко Дмитрий Евгеньевич, основатель исследовательского проекта, изучающего терапии, направленные на увеличение продолжительности жизни человека "Лаборатория Экспертных Исследований Тераностика_про" (nestarenie.ru/slb-expert_.html), создатель экспертной системы Тераностика_про, основатель Nestarenie Camp (https://nestareniecamp.ru), со-основатель on-line курса Nestarenie, автор книги "Диагностика старения" (https://nestarenie.ru/Diagnostika.pdf), и со-автор книги "Как дожить до 22 века" (http://book.hostenko.com), создатель блога https://nestarenie.ru, Тел. +7 925 9244328 Dmitriy-tae@yandex.ru
Группа nestarenieRU в Facebook www.facebook.com/groups/nestarenie
Мой аккаунт в Facebook: https://www.facebook.com/nestarenieRU
YouTube-канал https://www.youtube.com/c/nestarenieRU
Знаете ли вы, что сайт nestarenie.ru — объективно один из самых популярных в России ресурсов про старение и долголетие - в Яндексе, в Гугле, по количеству, качеству и лояльности аудитории. nestarenie.ru имеет потенциал, чтобы стать одним из самых популярных сайтов о борьбе со старением не только в России, но и в мире. Для этого нужны деньги. Я призываю всех сделать пожертвования, а также убедить своих друзей поступить аналогично.
-
-
- Карта Viza (доллары): 4215 8901 1587 0138 для переводов за пределами РФ
- Карта МИР в Сбере (рубли): 2202 2032 1501 6686 (МАЙЯВИ Ч.) - на территории РФ
-
Обязательно оставляйте свои комментарии под статьей, которую Вы читаете. Это очень важно для нас.
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить. Обязательно оставляйте свои комментарии под статьей, которую вычитаете. Это очень важно для нас.

Автор статьи
Веремеенко Дмитрий Евгеньевич
Телефон:
Почта:
Сфера деятельности - data science в медицине
Основатель проекта, изучающего терапии, направленные на увеличение продолжительности жизни человека (nestarenie.ru/slb-expert_.html)
Со-основатель IT сервиса продления жизни
Основатель форума о продлении жизни Nestarenie Camp (nestarenie.ru/camp.html)
Со-автор книги "Бонусные годы" (nestarenie.ru/kniga-3.html)
Создатель справочного блога о старении человека (nestarenie.ru)
Социальные сети:
- Карта Viza (доллары): 4215 8901 1587 0138 для переводов за пределами РФ
- Карта МИР в Сбере (рубли): 2202 2032 1501 6686 (МАЙЯВИ Ч.) - на территории РФ
Свежие комментарии
Подпишитесь на свежие статьи
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить.

39 комментариев
Я как понимаю Дмитрий,вы считаете что всё может обновить стволовые клетки и не нужны нам обычные клетки у которых оптимальная длина теломер, но вот уже есть информация что эти обычные клетки с короткими теломерами влияют на потенциал стволовых клеток,делая их менее активными…
Не существует лабораторных исследований, результаты которых свидетельствовали бы о том, что активация собственной теломеразы повышает риск развития рака. Согласно современным представлениям, теломераза – не необходимое условие запуска процесса озлокачествления ее экспрессия является обязательной только для поддержания роста большинства прогрессирующих злокачественных опухолей. Последние исследования, проведенные лабораторией Роберта де Пино (Robert de Pinho) из Гарвардского университета и испанской лаборатории Марии Бласко (Maria Blasco), посвящены изучению возможности манипуляций с теломеразой для снижения риска развития рака. Следует отметить, что ранние исследования, на основании которых десять лет назад было высказано беспокойство по поводу безопасности работы с теломеразой, были проведены этими же учеными.
Также проведено большое количество исследований, продемонстрировавших, что (а) экспрессия теломеразы не повышает риск развития рака у лабораторных животных и (b) короткие теломеры ассоциированы с очень высоким риском развития рака. По мнению автора, использование активаторов теломеразы значительно снизит вероятность развития рака. Это произойдет, во-первых, благодаря уничтожению провоспалительных клеток, являющихся потенциально канцерогенными из-за укороченных теломер, и во-вторых, за счет омоложения иммунной системы, обеспечивающей защиту организма от развития рака. В прошлом году автор опубликовал статью, посвященную этому вопросу (J.J.Mitteldorf, Telomere biology: Cancer firewall or aging clock?, Biokhimiya, 2013, Vol. 78, No. 9, pp. 1345–1353; перевод на русский доступен в «бумажном» издании журнала «Биохимия»).
Почему мы можем ожидать от удлинения теломер значительного увеличения продолжительности жизни
Ответ на этот вопрос очевиден, поэтому сформулируем его по-другому: какие факторы указывают на то, что увеличение длины теломер окажет очень мощное влияние на разнообразные аспекты биологии старения?
А) Укорочение теломер является древним механизмом старения
Протисты – это первые одноклеточные эукариоты, появившиеся на Земле миллиард лет назад (их структура значительно сложнее структуры бактерий, появившихся примерно на 3 миллиарда лет раньше). Протисты имеют линейную ДНК и, соответственно, потребность в теломеразе. Так как протисты размножаются простым делением, можно было бы предположить, что эти клетки не должны «стареть» или даже то, что концепция старения не имеет смысла для их клеточного цикла. Однако клеточные линии протистов могут стареть, а с некоторыми это в действительности происходит. В основе этого лежит самый старый из известных механизмов старения, заключающийся в воздержании от использования теломеразы.
В качестве примера можно привести парамеции (инфузории-туфельки). Репродукция парамеций заключается в делении клетки и репликации ДНК в отсутствии экспрессии теломеразы. В результате при каждом делении клетки происходит укорочение ее теломер. Парамеции могут вступать в конъюгацию, являющуюся примитивной формой полового обмена генетической информацией. Клетки двух парамеций сливаются и обмениваются ДНК, после чего разделяются. Экспрессия теломеразы характерна исключительно для процесса конъюгации. Поэтому любая не вступающая в конъюгацию клеточная линия вымирает через несколько сотен поколений. Это предотвращает возникновение чрезмерной однородности клеточных колоний. Таким образом, можно утверждать, что возраст механизма старения составляет миллиард лет, а некоторые из его генетических компонентов сохранялись и передавались через все трансформации многоклеточных форм жизни. William R Clark написал на эту тему де книги, находящиеся в открытом доступе [1, 2].
В) Теломеры человека укорачиваются с возрастом
Этот факт стал известен более 20 лет назад.
С) Люди с короткими теломерами входят в группу риска по преждевременной смертности
Этот факт установлен Ричардом Каутоном (Richard Cawthon, 2003) и описан в статье, удивившей специалистов, занимающихся изучением данного вопроса. В конце концов, если вся сложность процесса старения заключается в укорочении теломер, почему бы организму не решить эту проблему путем экспрессии теломеразы? Это бы усилило индивидуальную выносливость организмов. Почему же эволюция не воспользовалась таким простым приемом? (Ответ на это, конечно, заключается в том, что естественный отбор благоприятствует старению ради сохранения демографической стабильности. Большинство эволюционных биологов не рассматривают эту движущую силу эволюции.) Каутон продемонстрировал, что для 25% 60-летних участников исследования, имевших наиболее длинные теломеры, был характерен в два раза более низкий риск смерти, чем для 25% участников с наиболее короткими теломерами. Каутон имел доступ к уникальной базе данных, содержащей законсервированные образцы крови 20-летней давности. Насколько известно автору, в течение 11 лет (на момент написания данной статьи) никому не удалось ни воспроизвести, ни опровергнуть полученные Каутоном результаты.
D) При анализе данных с учетом возрастного фактора, люди с короткими теломерами входят в группу риска по развитию различных заболеваний, в особенности болезней сердечно-сосудистой системы
Эта взаимосвязь выявлена не только в оригинальном исследовании Каутона, но и при проведении целого ряда других работ [1, 2]. Продемонстрирована также взаимосвязь между длиной теломер и риском развития слабоумия [1, 2], а также сахарного диабета [1, 2].
Е) При анализе результатов с учетом возраста, животные с короткими теломерами также входят в группу высокого риска скорой смерти
Это было продемонстрировано в исследованиях на нескольких видах птиц [1, 2, 3] и павианах. Уже в 2003 году было установлено, что теломеры особей долгоживущих видов укорачиваются медленнее, чем теломеры представителей видов с малой продолжительностью жизни.
F) Небольшие исследования на мышах продемонстрировали способность стимуляторов теломеразы омолаживать организм животных
(Считается, что мыши являются значительно менее эффективной мишенью данной стратегии по сравнению с человеком, так как, судя по всему, старение человека намного сильнее зависит от укорочения теломер, чем старение мышей.)
Первый подобный эксперимент был проведен в 2008 году. Испанский исследователь Томас Лоба (Tomas-Loba) из лаборатории Марии Бласко создал генетически модифицированных мышей, одновременно устойчивых к раку и имеющих дополнительную копию гена теломеразы, экспрессируемую в некоторых тканях, для которых в норме экспрессия этого гена нехарактерна даже у мышей. Продолжительность жизни этих животных была на 18% выше продолжительности жизни устойчивых к раку мышей, имеющих только обычный ген теломеразы.
Впоследствии лаборатория Blasco работала с более мощным (хотя и более опасным) методом индукции теломеразы – инфицированием модифицированным ретровирусом, встраивающим ген теломеразы в ядерную ДНК инфицированных клеток. «Введение мышам в возрасте 1 и 2 года терапевтического аденоассоциированного вируса широкого тропизма, экспрессирующего мышиный ген TERT, оказывало выраженное влияние на состояние здоровья и выносливость животных, в том числе на такие показатели, как чувствительность тканей к инсулину, выраженность симптомов остеопороза, нервно-мышечная координация и несколько молекулярных биомаркеров старения» (Bernardes de Jesus et al., 2012). При начале терапии в 2-летнем возрасте продолжительность жизни мышей увеличивалась на 13%, а при начале терапии в возрасте 1 год – на 24%. При этом увеличения частоты развития рака не наблюдалось.
Наиболее выдающимся примером омоложения является достижение лаборатории Роберта де Пино из Гарвардского университета. Как правило, клетки мышей (в отличие от клеток человека) экспрессируют теломеразу на протяжении всей жизни. Исследователи создали модифицированных мышей, не имеющих нормальной (постоянно активной) версии гена теломеразы. Вместо этого животные имели ген теломеразы, который можно было активировать или инактивировать с помощью химического соединения, добавляемого в корм животных. По мере старения у таких мышей развивалось множество тяжелых симптомов дегенерации семенных желез, селезенки, кишечника, нервной системы и других органов. Прогрессирование этих симптомов не только прекращалось, но и обращалось вспять при активации теломеразы на поздних этапах жизни животных. Особенно интересным оказалось влияние на нервную систему, так как, в отличие от клеток кишечника и кожи, нервные клетки функционируют на протяжении всей жизни организма и не нуждаются в постоянном обновлении за счет стволовых клеток. Несмотря на это, у стареющих мышей с инактивированным геном теломеразы снижалась чувствительность органов чувств и способность к обучению. Активация теломеразы полностью восстанавливала эти нарушения.
Исследователи Стэнфордского университета и компании Geron провели эксперименты с «кожей», выращенной из клеток человека в лабораторных условиях. Они установили, что инфицирование клеток модифицированным ретровирусом, встраивающим в их геном ген теломеразы, обеспечивает искусственной коже восстановление эластичности, мягкости и фактуры, характерных для кожи молодого организма.
G) Помимо выполнения основной функции, заключающейся в удлинении теломер, теломераза выступает в роли своего рода гормона роста
Эта гипотеза была предложена в 90-х годах прошлого столетия и получила убедительное подтверждение в виде результатов, полученных учеными Стэнфордского университета [1, 2, 3, 4]. В рамках этой работы была создана линия мышей, имеющих измененную теломеразу, в которой отсутствовал компонент, необходимый для синтеза теломер. Несмотря на это, была продемонстрирована способность теломеразы индуцировать рост шерсти животных. Была также показана способность теломеразы воздействовать на гормональный сигнальный механизм, известный как Wnt. Другие функции теломеразы рассматриваются в статье Cong and Shay (2008).
Что интересно,ранее попадалась информация о влиянии Wnt на потенциал стволовых клеток кишечника…
Тогда ученые выяснили, что теломераза особенно активна в эмбриональных стволовых клетках, которые составляют зародыш на стадии нескольких дней, а потом, по мере дифференцировки клеток, ее работа постепенно сходит на нет. Исследователи забирали у зародышей мыши эмбриональные стволовые клетки и выращивали их в культуре, не давая превращаться в разные клеточные типы. При этом теломераза продолжала работать, пока теломеры не стали в два раза длиннее, чем в среднем у мышей.
Сейчас же исследователи взяли стволовые клетки со сверхдлинными теломерами и ввели их в обычные зародыши мышей. Клетки пометили зеленым флуоресцентным белком, чтобы отличать их от клеток реципиента. И оказалось, что из таких зародышей могут вырасти химерные мыши: плацента и зародышевые оболочки у них состоят из тканей реципиента, а вот сам эмбрион и будущая мышь полностью построены из флуоресцентных клеток с длинными теломерами.
Авторы работы проследили за жизнью таких мышей с рождения и до смерти. Первое, на что они обратили внимание — это комплекция этих мышей: они были существенно стройнее своих сородичей. Оказалось, что дело в проценте жира: мышечная масса у контрольных и экспериментальных животных не различалась, а вот толщина подкожного слоя и общее количество жира в теле у вторых было заметно ниже.
a – схема эксперимента: желтый – клетки обычной мыши, зеленый – флуоресцентные клетки с длинными теломерами; b – флуоресцентные клетки в тканях: верхний ряд – обычная мышь, нижний – мышь с длинными теломерами, красный цвет – окрашивание антителами к флуоресцентному белку; c – более стройная мышь с длинными теломерами рядом с контролем в возрасте 40 и 110 недель, d – динамика веса мышей, серый – контроль, черный – эксперимент
Исследователи проверили, насколько стройность мышей сказалась на их здоровье. Они обнаружили, что в крови мышей с длинными теломерами в два-три раза меньше липопротеинов низкой плотности — так называемого «плохого холестерина». Кроме того, экспериментальные мыши были более чувствительны к инсулину и быстрее справлялись с повышением количества глюкозы в крови.
Как и следовало ожидать, длинные теломеры продлили мышам и жизнь в целом: среднюю продолжительность жизни — на 13 процентов, а максимальную — на 8. А вот риск развития опухолей при этом не вырос: у экспериментальных мышей рак встречался в два раза реже, чем у контроля. Умирали же эти животные в основном из-за других возрастных болезней, например, инфекций матки.
Затем авторы работы проверили, что происходит в тканях у взрослых экспериментальных мышей. Они обнаружили, что теломеры у них в любом возрасте длиннее, чем у контрольной группы — пусть не в два раза, но на 25-50 процентов. При этом теломераза во взрослых клетках не работала — то есть длинные теломеры они сохранили еще с зародышевого периода. Других примет старения ученые тоже нашли меньше, чем в контроле — клетки с поврежденной ДНК или признаками старости у экспериментальных животных встречались в несколько раз реже.
Таким образом, исследователи развеяли опасения своих коллег о том, что длинные теломеры могут повлечь за собой негативные последствия для здоровья млекопитающих. Показательно и то, что удлинить мышам теломеры они смогли без каких бы то ни было генетических манипуляций — просто увеличив период, который эмбриональные клетки проводят в стволовом состоянии. На данный момент, конечно, сложно себе представить, как это можно было бы применить к человеку, однако сам факт того, что теломеры можно удлинить негенетическим путем и продлить таким образом жизнь, выглядит обнадеживающим.
Раньше ученые обнаружили, что теломеры страдают от внутриклеточных стрессов сильнее, чем вся остальная ДНК, потому что свободные радикалы атакуют их в первую очередь. А также, изучив динамику теломер у разных млекопитающих, пришли к выводу, что значение имеет не общая их длина, а скорость, с которой они теряются.
Существуют данные о том, что маленькие впадающие в спячку грызуны имеют бóльшую максимальную продолжительность жизни и медленнее стареют, чем грызуны того же размера, не впадающие в спячку [14]. Хотя рекордсменом по продолжительности жизни среди грызунов, конечно, является голый землекоп, который живет до 30 лет и обладает особыми адаптациями к долгожительству [15]. При исследовании теломерной биологии грызунов, впадающих в спячку, было обнаружено, что как в периоды оцепенения, так и во время спячки длина теломер у них остается постоянной или даже увеличивается [11, 12, 13]. Это может говорить о замедлении процесса старения. Однако у садовой сони при пробуждении — когда происходит так называемое оттаивание, и температура тела повышается — происходит усиление метаболизма, которое опосредуется окислительным стрессом и укорочением теломер [13]. Несмотря на это, компенсация длины теломер в другие периоды жизни позволяет этим грызунам жить дольше. В отличие от сонь, голый землекоп, по сути, является пойкилотермным животным с низким уровнем метаболизма и не испытывает стресса, связанного с повышением обмена веществ. В фибробластах у землекопа и у близких к нему по образу жизни и некоторым молекулярным адаптациям слепышей была обнаружена активная теломераза, а укорочения теломер с возрастом не происходило [16, 17, 18].
У летучих мышей, впадающих в спячку, во всех анализируемых органах (печень, поджелудочная железа, почки, легкие, сердце) была выявлена более высокая активность теломеразы по сравнению с представителями того же отряда, но в спячку не впадающими [19]. У ранее упомянутых впадающих в спячку грызунов, скорее всего, теломераза тоже активна. Это может объяснять поддержание теломер у животных, предпочитающих переживать неблагоприятные условия во сне.
Что интересно,что у поздних детей теломеры длиннее, так как чем старше родители,тем длиннее теломеры в их половых клетках, следовательно и у детей теломеры будут длиннее…Может быть природа это специально делает,так как родители данного ребёнка зачали его поздно,а следовательно и ребёнку нужно прожить подольше, чтобы он оставил потомство…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Более длинные теломеры не влияют на продолжительность жизни людей. Скорее – они лишь следствие более лучшего здоровья. Что касается поздних детей, то это установлено ретроспективно. Ретроспективно можно найти, что угодно, но это случайно. Это годится лишь для гипотезы
Добрый день Дмитрий! Есть ли смысл рассматривать Уабаин (он же строфантин) для замедления старения?
Международная группа ученых обнаружила еще одну группу веществ, которые могут работать как сенолитики, то есть убивать старые клетки в тканях. Это сердечные гликозиды — препараты, которые в малых дозах стимулируют сокращение сердечной мышцы, а в больших становятся ядом. Преимущество новообнаруженных сенолитиков в том, что они действуют на разные типы старых клеток, а также могут предупредить возникновение опухолей. Работа опубликована в журнале Nature Metabolism.
Ана Герреро (Ana Guerrero) с коллегами из Англии и Германии проверила 1280 фармакологических препаратов на способность уничтожать сенесцентные клетки. В качестве мишени они выбрали клетки с оверэкспрессией RAS: это известный онкоген, а его гиперактивность часто заставляет клетку досрочно состариться, чтобы не превратиться в опухолевую. Среди наиболее эффективных препаратов оказался уабаин (он же строфантин) — алкалоид из африканских растений.
Известно, что удаление сенесцентных клеток из тканей благоприятно сказывается на здоровье животного в целом. Поэтому исследователи проверили, что происходит с организмом пожилых (2 года) мышей, если им регулярно вводить уабаин в небольших дозах. По сравнению с контрольными мышами, у экспериментальных животных исчезли некоторые признаки старения: в крови повысилась концентрация альбумина и фосфатов, усилился мышечный хват и они стали дольше удерживаться на вращающейся планке — показатель двигательной активности и координации. В их почках, печени и сердце снизилось число сенесцентных клеток, а также иммунных клеток — то есть сенолитик справился не только с количеством клеток, но и с последствиями их активности.
Авторы работы предложили свою двухступенчатую модель борьбы с раком: сначала курс химиотерапии, который вызывает старение клеток, в том числе и опухолевых, а потом «удар» уабаином, который вычищает сенесцентные клетки из ткани. Свой метод они опробовали на культуре клеток рака кишечника, груди и меланомы — в живых остались порядка 10 процентов клеток.
nplus1.ru/news/2019/10/22/ouabain-senolytic
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Сенолитики не доказаны на людях. Есть основания полагать, что они будут сокращать жизнь людям, так как нам в отличии от мышей старые клетки нужнее. Они защищают от фиброза на ранней стадии
В данном исследовании использовалось 4 фактора Яманаки,2 из которых онкогены…сейчас уже научились преобразовывать без них…то есть опять же возникают вопросы,насколько они в данном исследовании выжали максимум из эпигенетического отката для продления жизни
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Как мы видим их кривой графика, там чисто математически понятно, что после 19 недели яманаки факторы вообще никак не работали. Так как наклон прямой был аналогичен контролю. А им делали факторы яманаки серийно и после 19 недели. То есть, возможно, как матрикс стал жесче, то откат в организме (не путать с клетками в культуре), не происходил.
У разных животных сшивки накапливаются с разной скоростью,чем дольше живет, тем медленнее…то есть в генетической программе вида это уже заложенно, с учётом того, сколько ему будет положено прожить…то ли у них фибробласты строят более устойчивый коллаген,то ли обмен коллагена быстрее, то ли система растворения сшивак работает лучше или же сшивки может строятся в каких-то слабых местах матрикса,которые образуются к примеру из-за более быстрого старения фибробластов у короткоживущих
Интересно то, что скорость образование сшивок коллагена может отличаться в десятки раз у разных видов… Значит данный исход происходит из-за различия в генах, которые так созданы работать у различных видов в зависимости какая продолжительность жизни заложена в виде… И гены могут сделать так, что и у мышей, у которых сшивки образуются быстрее в разы чем у человека можно редактировать так, что мутанты в этом уступать не будут человеку…
Ещё интересный факт, что не углеводная диета, а высокобелковая(возможно из-за плохого аминокислотного состава) сокращает жизнь дрозафилам… Конечно дрозафилы могут отличаться от людей в плане старение, но тем не менее…мне кажется, что у дрозафилы, что у червяка, что у человека, основная причина смерти может быть похожа, допустим только более сложнее… в среднем, что продлило жизнь одним, работало и на других, хотя и бывали исключения, что в принципе не удивительно…
Дмитрий, по факту, продление жизни прогерийных мышей было и весьма значительное, при том, что протокол включения эпигенетического отката возможно далёк от идеального… Там можно составить десятки разных методов администрирования и результат может кардинально отличаться(как при протоколе 3/5 в котором продолжительность жизни даже значительно сокращалась)… А математическое прогнозирования в таком сложном деле может запутать… Надо проверять все по факту без усложнений… Факт пока один, прогерийных мыши живут дольше на 50% при практически первой попавшийся комбинации…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Прогерейные мыши живут на 50% дольше на рапамицине и на 200-300% дольше на CR
Если мухам препараты замедляющие скорость роста и деления клеток продлевают жизнь аж на 48%,получается в их случае в основном не матрикс лимитирует их продолжительность жизни?!хотелось бы собрать абсолютно все исследования по теломерам с положительным и отрицательным результатам на продление жизни и сделать непредвзятые выводы… Дмитрий может могли бы скинуть исследования где теломеры не оправдали ожидания на продление жизни исходя из которых в к ним скептически относитесь… Те что я встречал отрицательные исследования в среднем менее убедительны чем положительные
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
То, что зажигалка в кармане ассоциируется с риском умереть от рака легких – не значит, что если ее убрать, то риск снизится. Также и теломеры. Нет ни одного клинического исследования на людях, доказывающего, что теломеры если увеличить, то люди будут жить дольше. Возможно и наоборот.
Культивируемые клетки, полученные от долгоживущих видов, имеют более высокую склонность к старению, когда им бросают вызов повреждения ДНК, чем клетки, полученные от короткоживущих видов. Предполагается, что клеточное старение может играть положительную роль в процессе развития, позволяя ему вносить свой вклад в эволюцию долголетия. Ранее было показано, что повышенная способность распознавать разрывы двойной нити ДНК положительно коррелирует с длительностью жизни, которая, по-видимому, связана с распознаванием концов ДНК гетеродимером Ku80-Ku70. То есть, чем дольше живет вид, тем короче теломеры и больше способность клеток к старению и самоуничтожению. Устойчивость к повреждению ДНК может также сочетаться с повышенной способностью к индукции апоптоза или клеточного старения. Голой кротовая крысы, которая живет очень долго, также предпочитает старение апоптозу по сравнению с мышиными клетками
link.springer.com/article/10.1007/s11357-019-00066-2
sciencedirect.com/science/article/pii/S0047637409001493?via%3Dihub
Также посмотрите по этому плейлисту лекции ученого Саши Коляды из Школы долголетия, у него своя лаборатория. Он как раз занимается теломерами. И там у него есть исследования про теломеры человека, что с долголетием связаны не длинные и не короткие, а средние. А также он делает выводы, что к теломерам нужно относиться, как к маркерам, а не как к причине.
https://nestarenie.ru/school.html
Меня убедит пожалуй только одно, исследование, где к примеру будет 3 группы мышей с достаточно большой выборкой, у одной искусственно укоротят теломеры с рождения,другой умеренно удлинят,у третьих будут поддерживать оптимальную длину теломер во время всей жизни(при этом должны меняться только теломеры и ничего более)…определят продолжительность их жизни и вероятность рака, также определят причину их смерти…тогда можно будет окончательно сказать работают или не работают…Таких исследований нету,если какие-то и попадались,то убеждали меня что теломеры работают…Насчёт длинных теломер я и ранее говорил,что это не хорошо,они должны быть оптимальной длины,теломером плохо когда колпачки слишком длинные, такие утверждения я встречал из исследований…Также часто встречается информация в историях больных раком женщин,что после поздней беременности(после 35 лет) у них скоро обнаруживали рак, не из-за того ли что при беременности теломеры сокращаются…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
А меня исследования на мышах не убедят вообще. У них совершенно другой характер старения.
интересное ещё есть вещество вырабатываемое клеткой под названием Ламин а…написано что нарушение в его синтезе приводит к ускоренному старению….это ядерная оболочка которая также влияет на эпигенетику
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Эпигенетика не причина старения
а в чем проблема на обычных мышах проверить? .. только не говорите про миллионы руб нужных на это .. сами расплодили да провели хоть примерные результаты бы видели .. интересно же
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Проблема в том, что проверяли, но результат пока скрывают.
так вы сами проверьте .. мыши не дорогие места много не занимают .. пару купить расплодить .. дома поставить две клетки можно ..
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Это должен проверять тот, кто считает – это панацей. Мы же не можем проверяиь тысячи панацей, которые не имеют доказательств
а вам не интересно? вас тысячи , по одному проверьте то до чего еще руки не дошли у науки .. так всю жизнь будете ждать когда кто то другой сделает или пока не дадут денег . потом поздно уже будет
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Такой эксперимент сто1цит 2 000 000 + еще много денег на факторы Яманаки. Но зачем, если эпи откат продлевал прогерейным мышам жизнь на 40%, а низкокалорийное питание на 200-300%.Даже рапасицин прогерейным мышам продлевал больше. А долгоживущим мышам гизкокалорийное питание уже на 20-30%, а мышам с нокаутом Ягенов рецепторов гормона роста уже на 0%. А люди это уже суперэкстремально живущие. Им уже ничто более 100 лет жизнь не продлевает, если случайно кто-то не прожил чуть больше. Кроме того, как видно в статье, в возрасте после 19 недель эпиоткат уже не продлевал жизнь ни на один 1%. А это значит, что нам с вами тоже уже не продлит ни на 1%
2 млн на что? мыши дешевые .. держать нескольких и кормить разными едой или препаратами и смотреть кто как долго проживет .. чисто для себя примерно без анализов и тд .. если будет интересный результат там уже и деньги найдутся .. просто так 2 млн никто не даст на такое .. что то должно заинтересовать .. например если обычные мыши проживут на чем то намного дольше других, этим можно будет заинтересовать спонсоров .. а просто так – дураков нет .. купят яхты .. раньше у ученых нищих были свои лаборатории .. щас какие то миллионы на мышей копеечных ждут ..
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
В прошлый раз, когда мы делали эксперимент с мышами, было потрачено 2 000 000. Их содержать нужно в специальных условиях и платить зарплату специалистом, которые будут за ними ухаживать. А сами факторы Яманаки и технология их доставки очень дорогие
Дмитрий .. ну при желании можно и десять млн потратить .. проблема чтоль .. за 2 млн я могу поухаживать за мышками .. не забудьте про меня ))) я даже их своим теплом обогрею .. даже за 1 млн .. сутками буду над ними сидеть пока не помрут .. а если серьезно для спонсора 2 млн на мышек так же смешно как для меня .. мы ж не шарим .. для нас это выглядит как развод на бабки .. ладно будем ждать китайцев которые за 2 тыщи руб все сделают
Ната, если это не проблема, то может и проверите сами. Дмитрий подскажет что к чему…
ЮрИ .. я их даже трогать боюсь .. да и уезжаю постоянно их выкинут на улицу или меня с ними сразу .. вот рыбки у меня несколько штук живут уже больше двух сроков максимальных жизни их бы проверить че там к чему .. как такое может быть? и раньше было что из большой стаи две три были мега долгожителями .. одна вообще довольно резвая двух других гоняет .. вот как так .. рыб вообще кто то проверял на это? может там какой секрет
Добрый день! Изучите препарат Новитал для продления молодости для поддержания гормона роста на должном уровне
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Гормон роста, чем выше, тем меньше живет человек.
У прогирийных мышей внеклеточный матрикс тоже быстрее стареет?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
У них похоже иная проблема, связанная с нарушением сигналила в ядро клеток из матрикса.
Спасибо очень интересно было почитать и вашу статью и ту которая по ссылке
Интересно, что будет с раковой и сенесцентной клеткой если им произвести эпигенетический откат… Также, видно что до сих пор не проверенна данная терапия на обычных не прогерийных мышах и до сих пор нету наиболее эффективного протокола циклов отката… Все весьма поверхностно изучина данная тема
Дмитрий, а что если стареем из-за допустим десятка различных факторов, а повлияли только на один…тогда график тоже будет по другому выглядит… Кстати график из исследования именно об этом говорит…есть периоды ускорения и замедления смертности…. То есть терапия влияет допустим на один фактор из к примеру десяти… На графике видно, что есть периоды ускоренной смертности и замедление смертности, но так как это лишь один фактор, то работает слабо
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Если чисто математически, то там нет влияния на старение вообще. Посмотрите видео на сайте – математика старения