Дата создания: 27 мая 2021
Обновлено: 12 февраля 2023
Удлинение теломер не замедляет старение и потенциально имеет шанс сократить продолжительность жизни человека
Математически старение — это процесс, приводящий к росту вероятности умереть с возрастом. Лекарство, которое не сокращает риск умереть с возрастом – не может замедлять старение [cdc.gov/nchs/data/nvsr/nvsr54/nvsr54_14.pdf].
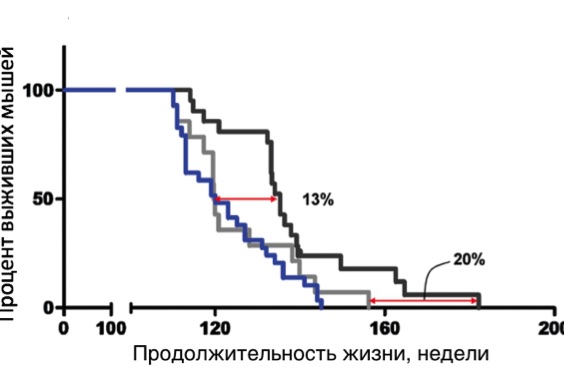 На рисунке кривые выживания. Черная линия - кривая выживания мышей, с удлинением теломер методами генной инженерии. наклон кривой выживания мышей с удлиненными теломерами не отличается от наклона кривой мышей в контрольной группе, что говорит о том, что удлинение теломер не влияло на скорость старения мышей. У мышей просто было немного лучше здоровья. Но это не имеет отношения к старению.
На рисунке кривые выживания. Черная линия - кривая выживания мышей, с удлинением теломер методами генной инженерии. наклон кривой выживания мышей с удлиненными теломерами не отличается от наклона кривой мышей в контрольной группе, что говорит о том, что удлинение теломер не влияло на скорость старения мышей. У мышей просто было немного лучше здоровья. Но это не имеет отношения к старению.
Укорочение теломер наблюдается при нормальном старении как у человека, так и у мышей. Ускоренное сокращение длины теломер сокращает жизнь мышей и людей [https://pubmed.ncbi.nlm.nih.gov/19812404]. Скорость укорочения теломер может быть замедлена посредством здорового питания и физической активности [www.ncbi.nlm.nih.gov/pubmed/26826704, www.ncbi.nlm.nih.gov/pubmed/21102320]. Исследования, посвященные связи между длиной теломер и продолжительностью жизни, дают противоречивые результаты [www.ncbi.nlm.nih.gov/pubmed/29186077]. Удлинение теломер позволяло увеличить максимальную продолжительность жизни мышей с 1000 до 1300 дней [www.ncbi.nlm.nih.gov/pubmed/22585399], однако не влияло на скорость их старения [www.ncbi.nlm.nih.gov/pubmed/27638422]. То есть удлинение теломер не влияло на процесс, приводящий к росту вероятности умереть с возрастом.
В предыдущем исследовании ген теломеразы TERT встраивали мышам при помощи аденоассоциированного вируса (AAV9), способного обеспечивать системную доставку. Такие многообещающие результаты привели к тому, что на фармацевтическом рынке появился очень дорогой индуктор теломеразы TA-65. Однако исследование этого препарата на мышах показало нулевой результат в увеличении продолжительности жизни [https://pubmed.ncbi.nlm.nih.gov/21426483].
Перед тем как перейти к генной терапии, эффекты теломеразы исследовались на трансгенных мышах. Оказалось, что если постоянно «активирован» ген TERT во всех клетках мыши, то может повышаться и риск рака у мышей [ncbi.nlm.nih.gov/pubmed/12034875] [ncbi.nlm.nih.gov/pubmed/27784441]
А может быть ученые какие-то не те теломеры удлиняли в предыдущем исследовании или как-то не так. Ведь главное для чего мы их хотим удлинить - это ожидание, что это снизит количество старых клеток в организме. И действительно, в результате укорочения теломер клетка в какой-то момент становится старой. Старение клеток сопровождается прекращением их деления. С возрастом число стареющих клеток растет [https://pubmed.ncbi.nlm.nih.gov/19812404]. Исследования показывают, что физические упражнения и исключение чрезмерного потребления калорий предотвращают преждевременное накопление стареющих клеток [www.ncbi.nlm.nih.gov/pubmed/26983960, www.ncbi.nlm.nih.gov/pubmed/27518560]. В то же время чем дольше живут животные, тем больше их клетки склонны к старению для защиты от мутаций [www.ncbi.nlm.nih.gov/pubmed/31098949]. В настоящий момент известна и вредная, и парадоксально полезная роль стареющих клеток в организме [www.ncbi.nlm.nih.gov/pubmed/29374361]. Так, например, стареющие клетки могут не только способствовать фиброзу, но и тормозить фиброз тканей [www.ncbi.nlm.nih.gov/pubmed/18724938]. Удаление стареющих клеток у мышей увеличило их максимальную продолжительность жизни примерно с 1000 до 1200 дней [www.ncbi.nlm.nih.gov/pubmed/26840489], но не влияло на скорость их старения [www.ncbi.nlm.nih.gov/pubmed/27638422]. А ведь чем дольше живет животное, тем сложнее увеличить ему продолжительности жизни. Не может ли тогда удаление старых клеток наоборот сократить жизнь долгоживущим мышам. Ведь примеров много. Например, рапамицин. Механизмом действия рапамицина у млекопитающих является подавление mTORC1 и mTORC2. mTOR расшифровывается, как mammalian Target Of Rapamycin — мишень рапамицина млекопитающих. Подавление mTORC1 — известный путь активации аутофагии. Так рапамицин рекордно увеличивал продолжительность жизни мышам. Однако, тот же рапамицин сильно сокращал продолжительность жизни долгоживущим мышам [https://pubmed.ncbi.nlm.nih.gov/29378959]. Поэтому потенциально терапия, удлиняющая теломеры, имеет шансы сокращать продолжительность жизни людей. Теломеры - это признак старения, а не причина. Так если высокий рост человека - маркер меньшей продолжительности жизни, то удаление ног скорее сократит продолжительность жизни.
В то же время чем дольше живут животные, тем больше их клетки склонны к старению для защиты от мутаций [www.ncbi.nlm.nih.gov/pubmed/31098949]. В настоящий момент известна и вредная, и парадоксально полезная роль стареющих клеток в организме [www.ncbi.nlm.nih.gov/pubmed/29374361]. Так, например, стареющие клетки могут не только способствовать фиброзу, но и тормозить фиброз тканей [www.ncbi.nlm.nih.gov/pubmed/18724938].
У мужчин теломеры были значительно длиннее, чем у женщин, однако мужчины живут меньше женщин [ncbi.nlm.nih.gov/pubmed/21194798]. В данном исследовании не найдено никаких доказательств значимой связь между длиной теломер в возрасте 70 лет и ухудшением памяти, скоростью обработки информации в возрасте 70 лет, или когнитивными нарушениями в возрасте от 11 до 70 лет. Нет доказательств связи между длиной теломер и результатами измерений физического здоровья. Данное исследование не поддерживает гипотезу о том, что длина теломер является полезным показателем биологического возраста в здоровой пожилой популяции. Это исследование показывает, что длина теломер не является достаточной для того, чтобы быть маркером незначительных различий в когнитивных изменениях в течение жизни между членами относительно здоровой 70 — летней популяции. Когнитивные способности в молодости не предсказывали длину теломер в возрасте 70 лет. Преимущества этого исследования заключались в большой выборке, а также в возрастной, этнической и географической однородности выборки, в наличие когнитивных оценок за 60 лет до 70 летнего возраста участников — в возрасте 11 лет [ncbi.nlm.nih.gov/pubmed/21194798].
Обзор 2017 года делает заключение, что длина теломер лейкоцитов не связана с продолжительность жизни. Физическая активность хорошо ассоциирована с продолжительностью жизни, но связь между физической активностью и длиной теломер не подтверждается в 50% исследований, что также ставит под сомнение ассоциации длины теломер с продолжительностью жизни людей.
ncbi.nlm.nih.gov/pubmed/29186077
Клетки тетраурелии парамеции имеют ограниченный клональный жизненный период и умирают примерно после 200 делений. Однако их теломеры не сокращаются. После примерно 200-от делений их ДНК накапливают много ошибок, и клетка погибает. Поэтому кажется, что теломеры не могут сделать нас бессмертными [ncbi.nlm.nih.gov/pubmed/8127914].
Сегодня для определения скорости старения ряд авторов используют эпигенетические часы Хорвата, основанные на оценке метилирования. Исследователи из нескольких учреждений, включая UCLA, Бостонский Университет, Стэнфордский Университет и Институт исследований старения на иврите SeniorLife, проанализировали образцы крови из почти 10 000 человек. Генетические маркеры в гене, ответственном за сохранение теломер, не связаны с более молодым биологическим возрастом людей. Варианты в гене TERT на хромосоме 5, которые связаны с более старым эпигенетическим возрастом, также были связаны с более длинными теломерами [eurekalert.org/pub_releases/2018-02/hsif-gwa020218.php].
Обязательно оставляйте свои комментарии под статьей, которую Вы читаете. Это очень важно для нас.
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить. Обязательно оставляйте свои комментарии под статьей, которую вычитаете. Это очень важно для нас.

Автор статьи
Веремеенко Дмитрий Евгеньевич
Телефон:
Почта:
Сфера деятельности - data science в медицине
Основатель проекта, изучающего терапии, направленные на увеличение продолжительности жизни человека (nestarenie.ru/slb-expert_.html)
Со-основатель IT сервиса продления жизни
Основатель форума о продлении жизни Nestarenie Camp (nestarenie.ru/camp.html)
Со-автор книги "Бонусные годы" (nestarenie.ru/kniga-3.html)
Создатель справочного блога о старении человека (nestarenie.ru)
Социальные сети:
- Карта Viza (доллары): 4215 8901 1587 0138 для переводов за пределами РФ
- Карта МИР в Сбере (рубли): 2202 2032 1501 6686 (МАЙЯВИ Ч.) - на территории РФ
Свежие комментарии
Подпишитесь на свежие статьи
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить.
18 комментариев
Если следовать Вашему определению старения, то увеличение медианной продолжительности жизни также снижает вероятность смерти с возрастом. А значит, что для этих целей подходит Коэнзим Q10. Ведь медианная часть увеличится вследствие снижения смерти от сердечно-сосудистых заболеваний.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Вы неверно понимаете определение. Снижение вероятности умереть с возрастом – это снижение скорости нарастания риска умереть. Это значит, что должна и максимальная продолжительность жизни продлеваться и наклон кривой выживания значительно меняться так, чтобы наклон кривой людей или животных на терапии был больше отклонен вправо. Увеличение лишь медианой продолжительности жизни говорит о том, что какая-то уязвимость была устранена, но старение даже ускорилось
Дмитрий, представьте себе следующее: мы, устраняя различные уязвимости, увеличиваем медианную часть до предела. В предельном варианте график превращается в прямую, которая резко обрывается вниз, и мыши (люди, зайцы) умирают все разом в очень короткий промежуток времени. Но это как раз говорит, что смерть запрограммирована. Все от чего-то умерли, хотя внешне выглядело все хорошо. И тут – бац! – куча трупов.
Что произойдет с человеком, который снизит себе смертность от сердечно-сосудистых заболеваний и увеличит медианную продолжительность жизни? А если он скорректирует свое питание и дополнительно резко снизит вероятность заболеть раком? Предположим, что он реально грамотно подобрал ингредиенты и ему дополнительно повезло не заболеть раком. Плюс он ещё принимает несколько добавок для мышц (уролитин а), а также ещё пару добавок, которые ему также увеличат медианную часть. Что произойдет, когда он будет приближаться к границе в 120 лет? Вот, он здоровый, спортом занимается, мышцы у него в порядке, рака нет, ссз нет, чтобы не умереть от простуды, не ходит мокрым под дождем, и т п. Судя по графикам, такой человек буквально за несколько лет придет в негодность и умрет, либо неожиданно умрет. Так почему же он должен умереть, если со здоровьем у него все было хорошо? Что такого произошло, что он не перешёл порог в 120 лет?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
“превращается в прямую” – это невозможно, так как старение повышает вероятность умереть. Вероятность – это не гарантия смерти в какой-то момент всех стразу.
Здоровые не умирают. Старение повышает риск заболеть и умереть от болезни.
Не возможно сохранить здоровье и умирать ни от чего.
Все от чего-то умирают – от каких-то болезней
Защитить себя от рака, ССЗ и так далее невозможно. Можно только снизить их риски.
А так даже 20-летние умирают от ССЗ и рака. Но только их вероятность заболеть низка, что сделало бы нестареющих 20-летних доживающими в среднем до 1000 лет
Я объясню связь. Стареющие клетки выделяют SASP – секреторный фенотип, связанный со старением.
Наличие SASP увеличивается с возрастом и индуцирует присутствие CD38 в иммунных клетках. Прочитайте внимательно эту статью: nmn.com/news/cd38-enzymes-on-immune-cells-drive-nad-decline-with-age Увеличение CD38 ведёт к снижению уровня NAD+.
Дальше рассмотрим деградацию “пути спасения” NAD+: [распад NAD+] – [увеличение NAM] – [снижение NAMPT с возрастом] – [снижение синтеза NMN] – [снижение уровня NAD+]. Почитайте внимательно статью: nickengerer.org/longevity-and-wellness/does-nmn-work-nad-boosting-biology-cd38 , а также продолжение: nickengerer.org/longevity-and-wellness/nuchido-time-nad-supplement-review-discount-code Из-за снижения NAD+ снижается активность SIRT1 и ускоряется уменьшение теломер. Далее – больше стареющих клеток — больше SASP — большее снижение CD38 — большее снижение NAD+, и т.д. Видимо, именно потому, что при увеличении SASP ускоряется падение NAD+, скорость снижения теломер возрастает и мыши быстрее умирают. Повышение смертности происходит не из-за увеличения стареющих клеток, а из-за снижения NAD+, которое происходит из-за активации CD38 и снижения уровня NAMPT.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Ваши статьи – это доклинические данные. Все доклинические данные настолько противоречивы, что в них можно найти аргументы в пользу любой точки зрения. 70% всех доклиниических данных не воспроизводятся из-за фальсификата, либо из-за наурушений [ncbi.nlm.nih.gov/pubmed/27225100].
Что касается стареющих клеток, то они могут не только способствовать фиброзу, но и тормозить фиброз «Thus, we demonstrate that cellular senescence acts to limit the fibrogenic response to tissue damage, thereby establishing a role for the senescence program in pathophysiological settings beyond cancer.» «the senescence of activated HSCs provides a barrier that limits liver fibrosis.», а старение в некоторых ситуациях может представлять собой гомеостатический механизм, который позволяет ткани вернуться к своему предразрушенному состоянию «Thus, senescence represents a homeostatic mechanism that enables the tissue to return to its predamaged state.» А их секреторный фенотип, связанный со старением как раз и являетс защитным для долгоживущих животных, когда количество стареющих клеток не много и не мало – оптимально.
cell.com/cell/fulltext/S0092-8674(08)00836-2?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS0092867408008362%3Fshowall%3Dtrue
В настоящий момент известна и вредная и парадоксально полезная роль сенесцентных клеток в организме. И что перевесит и в какой ситуации с точки зрения долголетия — предстоит еще долго выяснять в исследованиях [ncbi.nlm.nih.gov/pubmed/29374361].
Хваленный дазатиниб, как сенолитик, иногда просто приводит к снижению функциональной способности ткани, поскольку потеря сенесцентных клеток иногда не восполняется молодыми. Rho-kinase inhibition ameliorates dasatinib-induced endothelial dysfunction and pulmonary hypertension. europepmc.org/abstract/pmc/pmc5962749 Точно также Pax7-экспрессирующие сателлитные клетки, которые образуются еще на стадии эмбриона, незаменимы для регенерации скелетных мышц у взрослых и истощение их пула ведет к миопатии doi.org/10.1016/j.cell.2018.10.013
Что касается NAD+ и SIRT1, то это вообще наполовину натянутая за уши тема. Синклер — одна из самых противоречивых фигур науки, рассматриваемая многими как ловкий продавец, который переоценивает свою работу и ее потенциал. Некоторые критики съеживаются, когда он говорит о чудесных молекулах и вечной жизни. Другие шепчутся, что его наука, возможно, не совсем здорова. Однако в умении распиарить тему в области борьбы со старением, а затем грамотно продать этот хайп Дэвиду почти нет равных. В 2008 году он продал ресвератрол, активатор сиртуинов фармгиганту GlaxoSmithKline за 720 миллионов долларов, уверяя, что этот препарат через сто лет, возможно, будут принимать ежедневно, чтобы предотвратить сердечные заболевания, инсульт и рак [fiercebiotech.com/r-d/updated-gsk-moves-to-shutter-sirtris-cambridge-office-integrate-r-d, blogs.nature.com/news/2013/03/gsk-absorbs-controversial-longevity-company.html]. В 2010 году ученые Pfizer опубликовали статью, в которой говорилось, что при работе над сиртуинами Синклер не получил достоверных результатов, но опубликовал ложные выводы [bostonmagazine.com/health/2019/10/29/david-sinclair, ncbi.nlm.nih.gov/pubmed/20061378].
Несмотря на фиаско с ресвератролом, Синклер не перестает давать другие грандиозные обещания, не имеющие доказательств в исследованиях на людях. Одно из последних соединений, ставших объектом его интереса, — никотинамида мононуклеотид (NMN), донор NAD+ [bostonmagazine.com/health/2019/10/29/david-sinclair]. В журнале Time Синклер заявил, что NAD+ ближе всего к фонтану молодости. Добавление никотинамида рибозида, другого донора NAD+ в рацион мышей начиная с двухлетнего возраста увеличило максимальную продолжительность жизни животных на 5% – до 1015 дней [ncbi.nlm.nih.gov/pubmed/27127236], улучшая чувствительность клеток к инсулину. Однако первые рандомизированные контролируемые исследования действия приема доноров NAD+ на людях окончились провалом. Вопреки ожиданиям прием никотинамида рибозида у людей не изменял чувствительность клеток к инсулину [ncbi.nlm.nih.gov/pubmed/29992272, ncbi.nlm.nih.gov/pubmed/31390002], несмотря на то, что он достоверно повышал уровень NAD+ [ncbi.nlm.nih.gov/pubmed/29184669, ncbi.nlm.nih.gov/pubmed/30155270]. Он не оказывал влияния на митохондрии (энергетические станции клеток организма) скелетных мышц, количество и функции которых снижаются в процессе старения и при нарушении чувствительности к инсулину [ncbi.nlm.nih.gov/pubmed/31710095]. А опыты европейских ученых, вопреки результатам ранних исследований на животных, наоборот показали, что прием никотинамида рибозида ухудшает физическую работоспособность крыс на 35% по сравнению с контрольной группой. В частности, авторы этих исследований также показали, что никотиновая кислота, еще один донор NAD+, нарушает способность к длительным физическим нагрузкам. По некоторым данным никотинамид рибозид вызывает меньше побочных эффектов, чем никотиновая кислота, при этом применение обоих предшественников NAD+ почти одинаково повышают уровень NAD+ в большинстве типов клеток и тканей [ncbi.nlm.nih.gov/pubmed/27489522].
А что касается NAD+ и NMN, то весь пабмед пестрит исследованиями о том, как применение NMN может промотировать рак.
Например,
Additionally, a chemical screen to identify compounds that might affect mechanisms of cellular growth, survival, or death has yielded a potent small molecule inhibitor termed FK-866 ((E)-N-[4-(1-benzoylpiperidin-4-yl) butyl]-3-(pyridin-3-yl) acrylamide)[31]. FK866 induces apoptosis in HepG2 cells without having primary effects on cellular energy metabolism. Instead of causing immediate cytotoxicity, it inhibits Nampt and depletes the cells of NAD, suggesting that FK866 could be a promising agent against cancer cells that rely on nicotinamide to synthesize NAD[31].
pubmed.ncbi.nlm.nih.gov/19109034
Однако, FK866 effect in pancreatic cancer cell viability is blocked by NMN and nicotinic acid, but not by SIRT1 or PARP-1 inhibitors. A, PaTu8988t cells were treated with vehicle (control). The effect of FK866 on cell viability of PaTu8988t was completely reversed by treatment with the NAD precursors NMN and nicotinic Acid
clincancerres.aacrjournals.org/content/20/1/120.long
Так как избыток NAD+способствует канцерогенезу [https://pubmed.ncbi.nlm.nih.gov/30048742]. А снижение NAD+ рассматривается, как эффективная терапия рака. В том числе контроль оптимального NAD+ не выше нормальных значений — очень важен [https://pubmed.ncbi.nlm.nih.gov/27816507] [https://pubmed.ncbi.nlm.nih.gov/27582489]. А что делают добавки NMN? Они его повышают очень высоко. Может ли это повышать риск рака у человека — пока не исследовано.
Дмитрий, 1. Я Вам дал ссылки на статьи, где прием NMN позиционируется как неправильный подход. В настоящий момент я не топлю именно за NMN по причинам, указанным в статьях, тем более, что надо искать более коренную причину.
Исследования митохондрий в 2020 году показали, что дефектные митохондрии увеличивают уровень SASP nature.com/articles/s41580-020-0228-x?error=cookies_not_supported&code=ec9ef20c-f34c-4969-b9d7-358ea6c43c36 Возможно, в этом кроется ответ. Поисследуйте эту тему. Также митофагия очень ограничена в аксонах нервных клеток, что может быть реальной причиной нецродегенерации. С этой точки зрения, возможно, очень неплохо смотрится подход с Skq1, разрабатываемый в МГУ, и прием уролитина а с целью активизации митофагии.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Но Ионы Скулачева (SKQ) не продлевали жизнь мышам, когда они жили в нормальных условиях в новом виварии (см. график)
“female outbred SHR mice living in an old non-LP vivarium in St. Petersburg were short-lived (median lifespan about 300 days). They died mainly due to various infections. In these experiments, the median lifespan was doubled by very low doses of SkQ1 (5 nmol SkQ1/kg per day) which greatly decreased the infection-related mortality.”
ncbi.nlm.nih.gov/pubmed/22166671
Омолаживали ли Ионы Скулачева (SKQ) мышей в данном исследовании, или оказались альтернативой антибиотиков?
Дмитрий, обратите внимание на график. Если растёт только медианная часть, а максимальная продолжительность жизни практически не растёт, то это говорит о том, что есть некая точка, которую лабораторные животные преодолеть не могут. Давайте представим предельный случай, когда медианная максимизирована. Если она максимальна, то все 100% мышей живы до достижения определённой даты, а потом все 100% умирают. Если это так происходит (идеальный случай), то это говорит о том, что старение запрограммировано, поскольку нет распределения. Теперь вернемся к реальности. Если практически везде растёт медианная часть (средняя продолжительность жизни +, возможно, её качество), и лишь незначительно колеблется максимальная продолжительность жизни, то это говорит о запрограммированности процесса старения. Если бы это был только набор случайных / неслучайных повреждений, медианная бы так сильно не росла, либо с с ростом медианной части хороший сдвиг графика шёл бы вправо, но этого не происходит. Практически все особи не переживают определённую точку, несмотря на качественное улучшение жизненных условий, что означает, что это программа.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
ВЫ ПИШИТЕ: «SkQ1 проникают в центр митохондрий, снижают потенциал на мембране митохондрий и дополнительно перехватывают свободные радикалы»
МОЙ ОТВЕТ: «Если мы применяем митогорметины, то сигналы АФК из-за митогорметинов, как правило, являются транзиторными, и уменьшаются или даже отменяется в дальнейшем из-за адаптивной апрегуляции антиоксидантных ферментов в клетке и из-за более глобальной защиты от окислительного стресса, чем это делают антиоксиданты. Так как важно не только как работают антиоксиданты в борьбе с АФК, но и то, как клетка защищается от окислительного стресса. Антиоксиданты эту защиту не тренируют, так как все делают сами. И к тому же, антиоксиданты еще и защищают раковые клетки, а митогорметины — нет. К тому же в отличии, например, от пчел наш организм сам синтезирует полиненасыщенные жирные кислоты, независимо едим мы их или нет. А полиненасыщенные жирные кислоты очень сильно подвергаются перекисному окислению липидов. Для них гораздо важнее утечка катионов(Н+) а не анионов, которую блокируют митохондриальные антиоксиданты. Поэтому, если мы потребляем антиоксиданты, они не способны остановить перекидное окисление липидов. А применение митогорметинов уменьшает количество полиненасыщенных жирных кислот в клеточных мембранах, тем самым снижая сами полиненасыщенные жирные кислоты.
Антиоксиданты также способствуют выживанию как здоровых клеток, так и ослабленных, в то время как митогорметины не щадят ослабленные, вызывая селекцию, как волки в стаде овец.»
ВЫ ПИШИТЕ: «У мышей практически исчезают признаки дряхления (давайте будем называть это так — дряхление, чтобы не путать со старением)»
МОЙ ОТВЕТ: «НЕ исчезают. Мы не живем в трущобах и на помойках. У нас нормальный уровень медицины и хорошие санитарные условия. А у крыс, которых содержали в нормальном виварии SkQ1 не увеличил продолжительность жизни и не улучшил никакие показатели здоровья и одряхления – смотрите рисунок. А все улучшения – это было показано, когда крыс держали в плохих стрессовых условиях антисанитарии. А это уже тоже, что если бы у бомжа кожа была грубая и воспаленная, то лечение гидроксихлорохином его кожи улучшило бы его внешний вид. Но какое это имеет отношение к нам и к антистарению. К тому же жизнь продлевают только митогорметины, а антиоксиданты нивелируют их действие. Таким образом те, кто применяет SkQ1, лишает себя возможности продлить жизнь даже ЗОЖем. Так как бег трусцой – это тоже мотогорметин. А антиоксиданты нивелируют тренировочный эффект бега».
ВЫ ПИШИТЕ: «признаков здоровья улучшились, а они все равно загибаются почти в одной точке»
МОЙ ОТВЕТ: «именно так работает и гормон роста. Он сначала улучшает здоровье, но в долгосрочной перспективе ухудшает здоровье других систем. Это как взять здоровье взаймы. Это потому, что антиоксиданты лишают наш организм тренировки других антиоксидантных систем – смотрите мой первый ответ»
ВЫ ПИШИТЕ: «Значит, что-то «отключает» жизнь. Значит, есть какая-то программа, и мы копаем не туда (если брать не улучшение качества жизни, а преодоление максимально возможной её длины). Мыши упираются в какой-то барьер.»
МОЙ ОТВЕТ: «но это не программа, а накопление сшивок внеклеточного матрикса – здесь подробно за 6 минут видео почему мы стареем https://nestarenie.ru/pochemu-my-stareem-2.html»
ВЫ ПИШИТЕ: «Глюкозепан? У мышей этим и не пахнет. »
МОЙ ОТВЕТ: «причина – сшивки. У мышей другие сшивки преобладают. У долгоживущих животных глюкозепан. Так как глюкозепану нужно минимум лет 10, чтобы достичь значительной концентрации»
ВЫ ПИШИТЕ: «И с глюкозепановыми сшивками можно жить, это доказали долгожители: в теле 80-летнего человека уже 99% сшивок есть, а человек живёт и дальше, до 90 лет и более.»
МОЙ ОТВЕТ: «Это не верно. В теле 80 летнего человека разна концентрация сшивок в зависимости от того, как быстро человек старел. А 80 лет – это среднее арифметическое. Как 2 – это среднее арифметическое из 1 и 3»
ВЫ ПИШИТЕ: «С мышами глюкозепан не прокатит — его там нет!»
МОЙ ОТВЕТ: «у мышей есть глюкозепан, но на порядок меньше, чем у людей. Сшивок много видов. В зависимости от продолжительности жизни животных, разные сшивки вносят разный вклад. Люди научились бороться с теми сшивками, с которыми не могут бороться мыши, поэтому доживают до глюкозепана»
Ионы SkQ1 проникают в центр митохондрий, снижают потенциал на мембране митохондрий и дополнительно перехватывают свободные радикалы. У мышей практически исчезают признаки дряхления (давайте будем называть это так – дряхление, чтобы не путать со старением). Визуально мыши выглядят лучше, у них отменное здоровье, они бодрые, и т.д. (всего насчитано около 30 признаков улучшения здоровья, которые достигаются на подопытных мышах с помощью SkQ1). В организме человека 95%+ повреждений, исходящих от радикалов, наносят именно митохондрии. Итак, у мышей здоровье отменное, они бодры, а потом… резко погибают. Даже в случае приема SkQ1, который им улучшил видимые признаки. 30 признаков здоровья улучшились, а они все равно загибаются почти в одной точке и её практически не пересекают. Вам не кажется это странным? Как-будто дожили до определённого предела бодрыми и здоровыми (многие из них даже фертильность сохранили!) и вдруг – загнулись! При отсутствии дряхления.
Если бы старение было бы простым накоплением ошибок, то исключение токсичных радикалов, разрушительных для митохондрий, увеличило бы максимальную продолжительность жизни, но согласно графику этого не происходит. Значит, что-то “отключает” жизнь. Значит, есть какая-то программа, и мы копаем не туда (если брать не улучшение качества жизни, а преодоление максимально возможной её длины). Мыши упираются в какой-то барьер.
Глюкозепан? У мышей этим и не пахнет. И с глюкозепановыми сшивками можно жить, это доказали долгожители: в теле 80-летнего человека уже 99% сшивок есть, а человек живёт и дальше, до 90 лет и более. С мышами глюкозепан не прокатит – его там нет!
Итак, вопрос: если старение – это дряхление (накопление повреждений), тогда почему не было продления максимальной продолжительности жизни? Что “убило” мышей?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
ВЫ ПИШИТЕ: «SkQ1 проникают в центр митохондрий, снижают потенциал на мембране митохондрий и дополнительно перехватывают свободные радикалы»
МОЙ ОТВЕТ: «Если мы применяем митогорметины, то сигналы АФК из-за митогорметинов, как правило, являются транзиторными, и уменьшаются или даже отменяется в дальнейшем из-за адаптивной апрегуляции антиоксидантных ферментов в клетке и из-за более глобальной защиты от окислительного стресса, чем это делают антиоксиданты. Так как важно не только как работают антиоксиданты в борьбе с АФК, но и то, как клетка защищается от окислительного стресса. Антиоксиданты эту защиту не тренируют, так как все делают сами. И к тому же, антиоксиданты еще и защищают раковые клетки, а митогорметины — нет. К тому же в отличии, например, от пчел наш организм сам синтезирует полиненасыщенные жирные кислоты, независимо едим мы их или нет. А полиненасыщенные жирные кислоты очень сильно подвергаются перекисному окислению липидов. Для них гораздо важнее утечка катионов(Н+) а не анионов, которую блокируют митохондриальные антиоксиданты. Поэтому, если мы потребляем антиоксиданты, они не способны остановить перекидное окисление липидов. А применение митогорметинов уменьшает количество полиненасыщенных жирных кислот в клеточных мембранах, тем самым снижая сами полиненасыщенные жирные кислоты.
Антиоксиданты также способствуют выживанию как здоровых клеток, так и ослабленных, в то время как митогорметины не щадят ослабленные, вызывая селекцию, как волки в стаде овец.»
ВЫ ПИШИТЕ: «У мышей практически исчезают признаки дряхления (давайте будем называть это так — дряхление, чтобы не путать со старением)»
МОЙ ОТВЕТ: «НЕ исчезают. Мы не живем в трущобах и на помойках. У нас нормальный уровень медицины и хорошие санитарные условия. А у крыс, которых содержали в нормальном виварии SkQ1 не увеличил продолжительность жизни и не улучшил никакие показатели здоровья и одряхления – смотрите рисунок. А все улучшения – это было показано, когда крыс держали в плохих стрессовых условиях антисанитарии. А это уже тоже, что если бы у бомжа кожа была грубая и воспаленная, то лечение гидроксихлорохином его кожи улучшило бы его внешний вид. Но какое это имеет отношение к нам и к антистарению. К тому же жизнь продлевают только митогорметины, а антиоксиданты нивелируют их действие. Таким образом те, кто применяет SkQ1, лишает себя возможности продлить жизнь даже ЗОЖем. Так как бег трусцой – это тоже мотогорметин. А антиоксиданты нивелируют тренировочный эффект бега».
ВЫ ПИШИТЕ: «признаков здоровья улучшились, а они все равно загибаются почти в одной точке»
МОЙ ОТВЕТ: «именно так работает и гормон роста. Он сначала улучшает здоровье, но в долгосрочной перспективе ухудшает здоровье других систем. Это как взять здоровье взаймы. Это потому, что антиоксиданты лишают наш организм тренировки других антиоксидантных систем – смотрите мой первый ответ»
ВЫ ПИШИТЕ: «Значит, что-то «отключает» жизнь. Значит, есть какая-то программа, и мы копаем не туда (если брать не улучшение качества жизни, а преодоление максимально возможной её длины). Мыши упираются в какой-то барьер.»
МОЙ ОТВЕТ: «но это не программа, а накопление сшивок внеклеточного матрикса – здесь подробно за 6 минут видео почему мы стареем https://nestarenie.ru/pochemu-my-stareem-2.html»
ВЫ ПИШИТЕ: «Глюкозепан? У мышей этим и не пахнет. »
МОЙ ОТВЕТ: «причина – сшивки. У мышей другие сшивки преобладают. У долгоживущих животных глюкозепан. Так как глюкозепану нужно минимум лет 10, чтобы достичь значительной концентрации»
ВЫ ПИШИТЕ: «И с глюкозепановыми сшивками можно жить, это доказали долгожители: в теле 80-летнего человека уже 99% сшивок есть, а человек живёт и дальше, до 90 лет и более.»
МОЙ ОТВЕТ: «Это не верно. В теле 80 летнего человека разна концентрация сшивок в зависимости от того, как быстро человек старел. А 80 лет – это среднее арифметическое. Как 2 – это среднее арифметическое из 1 и 3»
ВЫ ПИШИТЕ: «С мышами глюкозепан не прокатит — его там нет!»
МОЙ ОТВЕТ: «у мышей есть глюкозепан, но на порядок меньше, чем у людей. Сшивок много видов. В зависимости от продолжительности жизни животных, разные сшивки вносят разный вклад. Люди научились бороться с теми сшивками, с которыми не могут бороться мыши, поэтому доживают до глюкозепана»
Дмитрий, 2. Я уверен, что если в организме падает уровень NAD+, это плохо: выключаются PARP1 и сиртуины, которые работали в молодости. Начинаются разные проблемы: накопление ошибок, деацетелирование гистонов, и т.д. В результате эпигенетика сдвигается в направлении старения. Если эпигенетика сдвигается “вправо”, а эпигенетические часы показывают ПОВЫШЕНИЕ ВЕРОЯТНОСТИ СМЕРТИ при сдвиге “вправо”, то эпигенетический откат “влево” представляет собой омоложение, поскольку снижается вероятность смерти от многих причин. Даже в Вашем понимании это есть омоложение (прочитайте 1 предложение Вашей статьи про математическую вероятность)
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Нет доказательств, что падение сиртуинов – плохо для человека. Это все для мышей и то не факт.
Что касается эпигенетики, то она не имеет отношения к старению, а просто отражает здоровье. Достаточно вести ЗОЖ и будет здоровье. А эпигенетика это просто покажет.
Эпигенетические часы предсказывают снижение вероятности смерти при их меньшем “значении”. А, исходя из Вашего определения, что “Математически старение — это процесс, приводящий к росту вероятности умереть с возрастом”, это и есть продление жизни конкретного индивидуума.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Точность предсказания смертности эпигенетическими часами уступает паспортному возрасту. Разве это оценка? И это окончательно ставит под сомнение практичность данного показателя, потому что он по сути не ценнее чем паспортный возраст.
Дмитрий, в одном из интервью Максим Скулачев рассказывал, что мыши, которые дожили до преклонного возраста и не успели схватить рак – мыши, которые имели хорошую хватку, были активными, у них были фибриссы, они были репродуктивны, и т.д. – внезапно “гасли”, садились в клетке в отдельное место и за несколько дней умирали. Это очень не похоже на внеклеточный матрикс.
Предлагаю Вам обратить внимание на микроРНК и исследовать эту тему. Какие “плюсы”: активация около 60% генов в организме; ответственны за многие процессы, в том числе за деление клеток (например, за деление кардиомицитов в утробе, после чего определённая микроРНК прекращает вырабатываться и деление прекращается, что говорит о выполнении определённой программы в определённом возрасте); микроРНК похожи на закодированные инструкции, которые различные органы и ткани (в том числе гипоталамус и гипофиз) рассылают по организму для активации генов (что сравнимо с исполнительными файлами, которые включают определённую программу). С возрастом идёт снижение концентрации микроРНК в синовиальной жидкости человека, и т.п.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Давайте не будет про рассказы, а будем доверять только исследованиям. На видео он показывает одно, а в его исследованиях другое.