Дата создания: 25 октября 2014
Обновлено: 31 мая 2023
Кандидаты на маркеры Тераностика_про
1. Трансформирующий Фактор Роста-β www.ncbi.nlm.nih.gov/pubmed/28327102 2. Плазменный карбоксиметиллизин 3. Сывороточный уровень карбокситерминального телопептида коллагена I типа (CITP) и уровень амино-терминального пептида проколлагена III типа (PIIINP) www.ncbi.nlm.nih.gov/pubmed/21900186 4. Сывороточный коллаген I типа (C1M) www.ncbi.nlm.nih.gov/pubmed/26288845 5. Матриксные металлопротеиназы-9 (MMP-9) и их тканевыми ингибиторами (TIMP-1) www.ncbi.nlm.nih.gov/pubmed/21283828 6. CD34(+)KDR(+) www.ncbi.nlm.nih.gov/pubmed/16873710 7. Маркер окислительного стресса липидов — 8-изопростана www.ncbi.nlm.nih.gov/pubmed/27042380 8. Анализ доли наивных Т-лимфоцитов (CD45RAhigh/CD27high) www.ncbi.nlm.nih.gov/pubmed/24510963 9. Фактор роста соединительной ткани (CTGF) (http://sci-hub.tw/10.1080/08977194.2016.1210142) (www.ncbi.nlm.nih.gov/pubmed/27686612) Уровень α-Kloto в плазме крови (www.ncbi.nlm.nih.gov/pubmed/21474560). Витамин К2 (МК-7) в крови - исследования доступны в ЛИС с 12.11.18. Метод - ВЭЖХ,
- Окисленные ЛПНП являются одним из основных факторов в развитии атеросклероза.
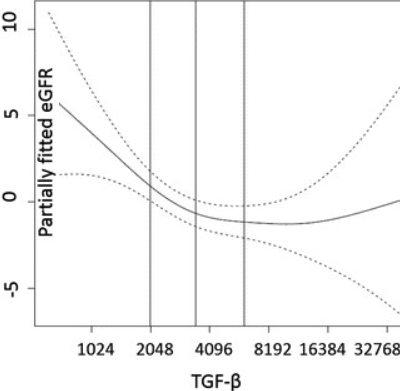 Трансформирующий Фактор Роста-β, который участвует в эпителиально мезенхимальном переходе, вызывающем фиброз — утрату органом его функции в результате разрастания соединительной ткани с появлением рубцовых изменений. Индукция Трансформирующий Фактор Роста-β вызывает накопление внеклеточного матрикса в клубочках почек, что, приводит к прогрессирующей болезнью почек. 2017 год, Университет Колорадо, США. В большой когорте пожилых людей (1722 человек), живущих в общинах в среднем в течение 9,5 лет, удвоение базовых уровней TGF-β плазмы немного, но независимо связано с более низкой скоростью клубочковой фильтрации почек (риск почечной недостаточности), но не с альбуминурией. Однако повышенные уровни TGF-β связаны с повышенным риском развития сердечно-сосудистых заболевание и смертности. TGF-β была 3482 (2042-6153) ng / L. Уровень TGF-β, связанный с наименьшим риском ССЗ, смертности и почечной недостаточности - менее 2042 нг/л. Удвоение TGF-β приводило к повышению риска (www.ncbi.nlm.nih.gov/pubmed/28327102)
Трансформирующий Фактор Роста-β, который участвует в эпителиально мезенхимальном переходе, вызывающем фиброз — утрату органом его функции в результате разрастания соединительной ткани с появлением рубцовых изменений. Индукция Трансформирующий Фактор Роста-β вызывает накопление внеклеточного матрикса в клубочках почек, что, приводит к прогрессирующей болезнью почек. 2017 год, Университет Колорадо, США. В большой когорте пожилых людей (1722 человек), живущих в общинах в среднем в течение 9,5 лет, удвоение базовых уровней TGF-β плазмы немного, но независимо связано с более низкой скоростью клубочковой фильтрации почек (риск почечной недостаточности), но не с альбуминурией. Однако повышенные уровни TGF-β связаны с повышенным риском развития сердечно-сосудистых заболевание и смертности. TGF-β была 3482 (2042-6153) ng / L. Уровень TGF-β, связанный с наименьшим риском ССЗ, смертности и почечной недостаточности - менее 2042 нг/л. Удвоение TGF-β приводило к повышению риска (www.ncbi.nlm.nih.gov/pubmed/28327102)- 2009 год, Университета Джона Хопкинса, США. Одним из перспективных биомаркеров, показывающих не только накопление конечных продуктов гликирования, но и увеличение риска смертности от всех причин, является плазменный карбоксиметиллизин. Карбоксиметил-лизин является одним из доминирующих КПГ в организме, как циркулирующих, так и тканевых. Кроме этого, карбоксиметиллизин является единственным конечным продуктом гликирования, который выступает лигандом для рецепторов конечных продуктов гликирования (RAGEs). Связывание RAGE с карбоксиметил-лизином приводит к увеличению генерации свободных радикалов, активации пути ядерного фактора Nf-κB и повышению уровня медиаторов воспаления (таких, как фактор некроза опухоли-альфа, интерлейкин-6 и C-реактивный белок). Известно, что карбоксиметиллизин накапливается в больших кровеносных сосудах с возрастом. И высокие концентрации этого конечного продукта гликирования в сыворотке связаны с большей артериальной жесткостью, мощным фактором риска развития сердечно-сосудистых патологий и смертности от них, что было показано в ходе Балтиморского продольного исследования старения. Также известно, что у пожилых людей с церебрально-сосудистыми заболеваниями повышенный уровень карбоксиметиллизина обнаруживается в кортикальных нейронах и сосудах головного мозга, что связано с тяжестью когнитивных нарушений. В рамках 6-летнего исследования Invecchiare in Chianti, в котором приняли участие 1013 человек старше 65 лет, было показано, что средняя концентрация карбоксиметиллизина в плазме, которую измеряли иммуноферментным анализом, была значительно выше у тех людей, которые умерли от всех причин, чем у выживших. То есть, у тех людей, в плазме которых карбоксиметиллизин составлял более чем 396 нг/мл. В 2018 году группа датских и шведских учёных описала новое моноклональное антитело, D1-B2, нацеленное на карбоксиметиллизин, которое имеет хороший потенциал при иммуноферментном анализе для обнаружения данного конечного продукта гликирования. (www.ncbi.nlm.nih.gov/pubmed/19023277) (www.ncbi.nlm.nih.gov/pubmed/19682127)(www.ncbi.nlm.nih.gov/pubmed/29420566) (www.ncbi.nlm.nih.gov/pubmed/14066470)
-
2011 год, госпиталь Святого Франциска. Отложение коллагеновых фибриллов во внеклеточном матриксе сердечной мышцы увеличивается с возрастом и играет ключевую роль в патофизиологии сердечной недостаточности. Ученые наблюдали 880 участников исследования (средний возраст, 77±6 лет; 48% женщин) в течение 12±4 лет (в диапазоне 3-17 лет). Как у здоровых, так и у пожилых людей с сердечно-сосудистыми заболеваниями, подверженными риску развития сердечной недостаточности, сывороточный уровень карбокситерминального телопептида коллагена I типа (CITP) от 4,3 мкг/л и выше, а также уровень амино-терминального пептида проколлагена III типа (PIIINP) от 3,0 нг/мл и выше, значительно связаны со множественными неблагоприятными исходами сердечной деятельности, включая инфаркт миокарда, и смерть (www.ncbi.nlm.nih.gov/pubmed/21900186)
- Витамин К2 (МК-7) в крови.
- Сульфорафан в крови.
-
2015 год, Центр клинических и фундаментальных исследований, Дания. Хронические фиброзно-пролиферативные заболевания связаны почти с 45% всех смертей в развитых странах. Матриксные металлопротеиназы 1 типа (MMP-1) разрушают внеклеточный матрикс и играют важную роль в развитии болезни. Деградация коллагена I типа играет большую роль в этом вопросе. Проспективное исследование в когорте датских женщин (5855 человек) в возрасте 48-89 лет показало, что у пациентов с высоким содержанием сывороточного коллагена I типа (C1M) (56.1–458.8 нг/мл) повышена смертность от всех причин в 2 раза. Причины смертности — сердечно-сосудистые заболевания и рак. Самая низкая смертность наблюдалась при (C1M) 21.2–31.3 нг/мл (www.ncbi.nlm.nih.gov/pubmed/26288845)
- 2011 год, Уппсальский Университет, Уппсала, Швеция. Оборачиваемость внеклеточного матрикса во всех твердых органах определяется в основном балансом между деградирующими матрикс ферментами под названием матриксные металлопротеиназы (MMP) и их тканевыми ингибиторами (TIMP). Высокие показатели MMP-9 связаны со смертностью от не сердечно-сосудистых заболеваний. Так, если у наблюдаемых изначально MMP-9 были выше 462 нг/мл, то они имели самую высокую смертность (см. картинку). Меньше всех умирали те, кто имел MMP-9 ниже 228 нг/мл.
Высокие показатели TIMP1 были связаны с более высоким риском развития инсульта и смертности от сердечно-сосудистых заболеваний. Так, если у наблюдаемых изначально TIMP1 были выше 238 нг/мл, то они имели самую высокую смертность (см. картинку). Меньше всех умирали те, кто имел TIMP1 ниже 166 нг/мл (www.ncbi.nlm.nih.gov/pubmed/21283828)
-
2006 год, Медицинская школа Университета Падуи, Италия. Экспериментальные исследования показали, что эндотелиальные прогениторные клетки участвуют в ремонте и защите эндотелия сосудов. Нарушение эндотелиального слоя является первым шагом в развитии атеросклероза. Для того, чтобы это показать ученые исследовали 137 здоровых испытуемых, сравнивали их КИМ сонных артерий, высокочувствительный с-реактивный белок, уровень циркулирующих в крови эндотелиальных прогениторных клеток, а также риск сердечно-сосудистых заболеваний. Шесть субпопуляций прогениторных клеток были определены методом проточной цитометрии на основе поверхностной экспрессии антигенов CD34(+), CD133(+), CD34(+)CD133(+), CD34(+)KDR(+), CD133(+)KDR(+), and CD34(+)CD133(+)KDR(+). Среди различных антигенных профилей эндотелиальных прогениторных клеток только CD34(+)KDR(+) клетки были значительно уменьшены у пациентов с повышенным КИМ. Клетки CD34(+)KDR(+) имели обратную корреляцию с КИМ независимо от других сердечно-сосудистых параметров даже после поправки на высокочувствительный с-реактивный белок и 10-летний риск сердечно-сосудистых заболеваний (Framingham risk). Был сделан вывод, что истощение гемопоэтических стволовых клеток, а также снижение числа и функции эндотелиальных прогениторных клеток является независимым маркером раннего субклинического атеросклероза у здоровых людей и может дать дополнительную информацию за пределами классических факторов риска и воспалительных маркеров (www.ncbi.nlm.nih.gov/pubmed/16873710)
-
Раннее кормление с ограничением по времени (eTRF) значительно снизило маркер окислительного стресса липидов — 8-изопростана на 11 ± 5 пг/мл. 8-изопростан производится в результате окисления мембранных фосфолипидов. Это может снижать риск атеросклероза. К тому же аллометрические уравнения, показывают, что снижение на 24% индекса перекисного окисления митохондриальных фосфолипидов печени и на 19% индекса перекисного окисления фосфолипидов скелетных мышц связано с удвоением продолжительности жизни. Чтобы удвоить продолжительность жизни надо снизить индекс пероксидации липидов на 19%. Липидный состав мембран клеток позволяет также объяснить разницу между продолжительностью жизни рабочих пчел и королев, а также птиц и млекопитающих. Птицы живут значительно дольше млекопитающих тех же размеров (www.ncbi.nlm.nih.gov/pubmed/15757684) (http://sci-hub.tw/10.1016/j.jtbi.2004.11.024#) (www.ncbi.nlm.nih.gov/pubmed/17446027). Индекс пероксидации липидов может отражать скорость старения внеклеточного матрикса — важного механизма старения человека. А значит диета eTRF вполне возможно снижает не только маркер окислительного стресса липидов — 8-изопростан 8-iso-Prostaglandin F2α (also known as 8-epi-PGF2α, 8-isoprostane, or 15-isoprostane F2t - www.cellbiolabs.com/sites/default/files/STA-337-isoprostane-assay-kit.pdf), но и индекс пероксидации митохондриальных фосфолипидов, а также скелетных мышц (www.ncbi.nlm.nih.gov/pubmed/29754952). 8-изопростан вовлечен в атерогенез, а его повышенные уровни связаны с гепаторенальным синдромом, ревматоидным артритом, канцерогенезом, а также атеросклерозом. Повышенный уровень 8-изопростана у людей с нормальным ИМТ был связан с ростом общей смертности на 34-36% www.ncbi.nlm.nih.gov/pubmed/27042380 (2012 год, Университет Висконсина-Медисонская школа медицины и общественного здравоохранения, Мэдисон, США - 19 летнее популяционное исследование в возрасте 43-86 лет). Считается, что нормальные уровни 8-изопростана в плазме здоровых людей около 40-100 пг/мл (www.cellbiolabs.com/sites/default/files/STA-337-isoprostane-assay-kit.pdf). Однако наименьший риск смертности от всех причин связан с уровнем 8-изопростана в плазме 97 - 123,9 пг/мл. Ниже 97 пг/мл смертность немного повышается. Выше 123,9 пг/мл смертность повышается также. Но самая высокая смертность у тех, чей уровень 8-изопростана равен или больше 164 пг/мл (www.ncbi.nlm.nih.gov/pubmed/27042380). Интересно, что уровень 8-изопростана повышен также при депрессии (www.ncbi.nlm.nih.gov/pubmed/20417039), при излишней массе тела (ИМТ выше 28) с возможным снижением при похудении (www.ncbi.nlm.nih.gov/pubmed/12387653). Повышенные уровень 8-изопростана и 8 oxo DGsn в исследовании с участием 9949 мужчин и женщин в возрасте 50-75 лет были независимо связаны с более высоким риском ССЗ. Кроме того, предсказание риска смертности от ССЗ было значительно улучшено при добавлении этих двух биомаркеров в инструмент систематической оценки коронарного риска Европейского общества кардиологии (www.ncbi.nlm.nih.gov/pubmed/30100224)
- По результатам последних исследований (www.ncbi.nlm.nih.gov/pubmed/24510963), доля наивных Т-клеток как в CD4+ (Т-хелперы) так и в CD8+ (Т-киллеры) субпопуляциях периферической крови человека линейно уменьшается с возрастом. В детстве она составляет 50–80% от всего Т-клеточного пула и уменьшается на 0,75% каждый год, к 70 годам она составляет одну четверть первоначального изобилия. При анализе доли наивных Т-лимфоцитов (CD45RAhigh/CD27high) в CD8+ (киллеры) субпопуляции периферической крови доноров оказалось, что она падает линейно с возрастом донора. Доля наивных Т-клеток в CD4+ (хелперы) субпопуляции также падает линейно (R = -0.75) и со схожей кинетикой, но лишь у доноров моложе 70 лет. В группе же долгоживущих доноров происходит увеличение процента содержания наивных Т-лимфоцитов в CD4+ субпопуляции в 1.7 раз по сравнению с донорами Группы 3. Чтобы оценить корреляцию между процентом наивных Т-клеток в периферической крови, возрастом донора и наблюдаемым разнообразием TCRβ, измеряли долю наивных Т-клеток (CD45RAhigh/CD27high) каждого из исследуемых образцов методом проточной цитофлуориметрии. Увеличение доли наивных Т-клеток в пуле CD4+, а значит и увеличение разнообразия TCR обеспечивает лучшую иммунорегуляторную функцию, что снижает общее воспаление, усиливающееся по мере старения организма из-за активации аутоиммунных процессов, увеличивает эффективность распознавания раковых клеток и обеспечивает более сбалансированный иммунный ответ.
-
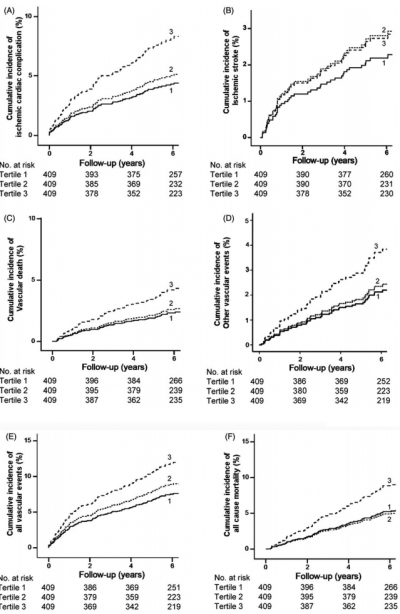 2016 год, Университетский медицинский центр Утрехт, Нидерланды. Фактор роста соединительной ткани (CTGF) играет ключевую роль в фиброгенезе ткани. Все больше доказательств его роли в патогенезе сердечно-сосудистых заболеваний и почечной недостаточности. В проспективном когортном исследовании в течение 6,5 лет (5.3-7.4) наблюдались 1227 пациентов (средний возраст 59,0 ± 9,9 года) с явно выраженными сосудистыми заболеваниями (атеросклероз сосудов) у которых измеряли фактор роста соединительной ткани (CTGF) в плазме крови. Как оказалось, у пациентов явно выраженными сосудистыми заболеваниями, повышенный плазменный уровень CTGF (1.48 нмоль/л и выше ) в начале исследования связан с повышенным риском новых сердечно-сосудистых событий (в частности, ишемических кардиальных осложнений) и смертности от всех причин в течение следующих 6,5 лет наблюдения. В предыдущих исследованиях CTGF был найдет, как независимый предиктор общей смертности у пациентов с диабетической нефропатией. Это связано с тем, что CTGF - ключевой детерминант активности тканевого фиброгенеза и фиброза как общего конечного пути развития хронических заболеваний различной этиологии. (http://sci-hub.tw/10.1080/08977194.2016.1210142) (www.ncbi.nlm.nih.gov/pubmed/27686612)
2016 год, Университетский медицинский центр Утрехт, Нидерланды. Фактор роста соединительной ткани (CTGF) играет ключевую роль в фиброгенезе ткани. Все больше доказательств его роли в патогенезе сердечно-сосудистых заболеваний и почечной недостаточности. В проспективном когортном исследовании в течение 6,5 лет (5.3-7.4) наблюдались 1227 пациентов (средний возраст 59,0 ± 9,9 года) с явно выраженными сосудистыми заболеваниями (атеросклероз сосудов) у которых измеряли фактор роста соединительной ткани (CTGF) в плазме крови. Как оказалось, у пациентов явно выраженными сосудистыми заболеваниями, повышенный плазменный уровень CTGF (1.48 нмоль/л и выше ) в начале исследования связан с повышенным риском новых сердечно-сосудистых событий (в частности, ишемических кардиальных осложнений) и смертности от всех причин в течение следующих 6,5 лет наблюдения. В предыдущих исследованиях CTGF был найдет, как независимый предиктор общей смертности у пациентов с диабетической нефропатией. Это связано с тем, что CTGF - ключевой детерминант активности тканевого фиброгенеза и фиброза как общего конечного пути развития хронических заболеваний различной этиологии. (http://sci-hub.tw/10.1080/08977194.2016.1210142) (www.ncbi.nlm.nih.gov/pubmed/27686612) 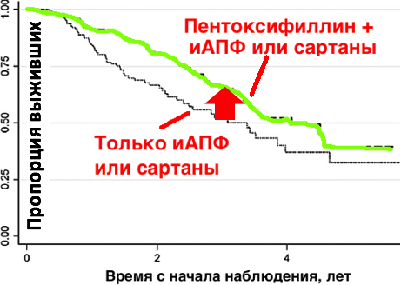 Важно отметить, что по данным 2014 года, от Национальной Больницы Тайваньского Университета сочетание пентоксифиллина с иАПФ или с сартанами еще более эффективно для лечения хронической почечной недостаточности, для снижения уровня протеинурии и снижения общей смертности. Мета-анализ 2015 года - сочетание пентоксифиллина с сартанами (либо с иАПФ) безопасно. Прогресс в терминальной стадии почечной недостаточности характеризуются диффузным фиброзом. Пентоксифиллин - мощный ингибитор фактора роста соединительной ткани (CTGF), несмотря на постоянный уровень TGF-β1 из-за активации ангиотензином II тормозил фиброз почек, снижая CTGF. Пентоксифиллин при запущенной степени хронической почечной недостаточности защищал почки лучше, чем монотерапия лекарствами группы сартаны или иАПФ. Комбинация пентоксифиллина с иАПФ может почти полностью заблокировать прогресс заболевания почек (www.ncbi.nlm.nih.gov/pubmed/24512756) (www.ncbi.nlm.nih.gov/pubmed/25862237) (www.ncbi.nlm.nih.gov/pubmed/26082272)
Важно отметить, что по данным 2014 года, от Национальной Больницы Тайваньского Университета сочетание пентоксифиллина с иАПФ или с сартанами еще более эффективно для лечения хронической почечной недостаточности, для снижения уровня протеинурии и снижения общей смертности. Мета-анализ 2015 года - сочетание пентоксифиллина с сартанами (либо с иАПФ) безопасно. Прогресс в терминальной стадии почечной недостаточности характеризуются диффузным фиброзом. Пентоксифиллин - мощный ингибитор фактора роста соединительной ткани (CTGF), несмотря на постоянный уровень TGF-β1 из-за активации ангиотензином II тормозил фиброз почек, снижая CTGF. Пентоксифиллин при запущенной степени хронической почечной недостаточности защищал почки лучше, чем монотерапия лекарствами группы сартаны или иАПФ. Комбинация пентоксифиллина с иАПФ может почти полностью заблокировать прогресс заболевания почек (www.ncbi.nlm.nih.gov/pubmed/24512756) (www.ncbi.nlm.nih.gov/pubmed/25862237) (www.ncbi.nlm.nih.gov/pubmed/26082272) -
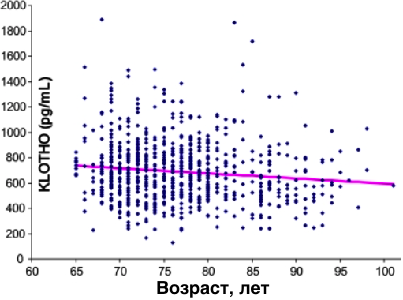 20 лет назад, в 1997 году японские и американские ученые во главе с Yo-ichiNabeshima обнаружили новый ген долголетия и дали ему название в честь греческой богини судьбы, плетущей нить жизни — Klotho. Клото, прявшая нить жизни, Лахесис, тянувшая эту нить, Атропос, которая ее обрезала) — в греческой мифологии дочери Зевса и Фемиды, богини неотвратимой судьбы. Выключение Клото у трансгенных мышей вызывало синдром ускоренного старения. А еще через 7 лет те же исследователи выяснили, что и активация klotho значительно продлевает мышам жизнь – самцам на 20-30%, а самкам – до 19%. Уровень белка klotho снижается с возрастом (см. рисунок слева) (www.ncbi.nlm.nih.gov/pubmed/16123266) (http://onlinelibrary.wiley.com/doi/10.1002/acn3.161/abstract).Klotho, уменьшает жёсткость артерий и повышают их эластичность (www.ncbi.nlm.nih.gov/pubmed/26981496) (www.ncbi.nlm.nih.gov/pubmed/24322608).Всего 12 недель умеренных аэробных упражнений увеличивают плазменный уровень белка Клото и уменьшают жесткость артерий (www.ncbi.nlm.nih.gov/pubmed/26981496) (www.ncbi.nlm.nih.gov/pubmed/24322608)Рандомизированные контролируемые исследования показали, что лечение валсартаном и другими сартанами увеличивает экспрессию белка долголетия klotho (трансмембранный белок, регулирующий чувствительность организма к инсулину и отвечающий за скорость старения) (www.ncbi.nlm.nih.gov/pubmed/23929932)(www.ncbi.nlm.nih.gov/pmc/articles/PMC3108350)(http://jra.sagepub.com/content/early/2013/02/04/1470320313475905.full)
20 лет назад, в 1997 году японские и американские ученые во главе с Yo-ichiNabeshima обнаружили новый ген долголетия и дали ему название в честь греческой богини судьбы, плетущей нить жизни — Klotho. Клото, прявшая нить жизни, Лахесис, тянувшая эту нить, Атропос, которая ее обрезала) — в греческой мифологии дочери Зевса и Фемиды, богини неотвратимой судьбы. Выключение Клото у трансгенных мышей вызывало синдром ускоренного старения. А еще через 7 лет те же исследователи выяснили, что и активация klotho значительно продлевает мышам жизнь – самцам на 20-30%, а самкам – до 19%. Уровень белка klotho снижается с возрастом (см. рисунок слева) (www.ncbi.nlm.nih.gov/pubmed/16123266) (http://onlinelibrary.wiley.com/doi/10.1002/acn3.161/abstract).Klotho, уменьшает жёсткость артерий и повышают их эластичность (www.ncbi.nlm.nih.gov/pubmed/26981496) (www.ncbi.nlm.nih.gov/pubmed/24322608).Всего 12 недель умеренных аэробных упражнений увеличивают плазменный уровень белка Клото и уменьшают жесткость артерий (www.ncbi.nlm.nih.gov/pubmed/26981496) (www.ncbi.nlm.nih.gov/pubmed/24322608)Рандомизированные контролируемые исследования показали, что лечение валсартаном и другими сартанами увеличивает экспрессию белка долголетия klotho (трансмембранный белок, регулирующий чувствительность организма к инсулину и отвечающий за скорость старения) (www.ncbi.nlm.nih.gov/pubmed/23929932)(www.ncbi.nlm.nih.gov/pmc/articles/PMC3108350)(http://jra.sagepub.com/content/early/2013/02/04/1470320313475905.full)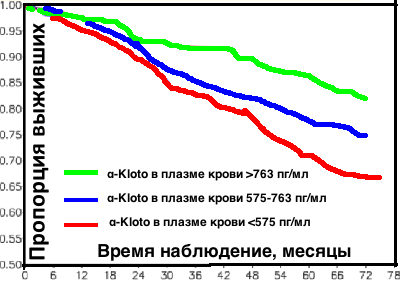 12011 год, Балтимор, США. Ученые изучили уровень α-Kloto в плазме крови у 804 взрослых (мужчины и женщины в возрасте 65 лет и старше) живущих в Тоскане (Италия), за которыми наблюдали в течение 6 лет. За этот период умерли 194 (24,1%) участников исследования. Самую высокую смертность имели те, у кого уровень α-Kloto в плазме крови был самым низким <575 пг/мл. Самую низкую смертность имели те, у кого уровень α-Kloto в плазме крови был самым высоким >763 пг/мл. Более низкий уровень α-Kloto в плазме крови был связан с более старым возрастом, более низким кальцием в костях, более низким ЛПВП, более высокими триглицеридами и большим когнитивным ухудшением (www.ncbi.nlm.nih.gov/pubmed/21474560)
12011 год, Балтимор, США. Ученые изучили уровень α-Kloto в плазме крови у 804 взрослых (мужчины и женщины в возрасте 65 лет и старше) живущих в Тоскане (Италия), за которыми наблюдали в течение 6 лет. За этот период умерли 194 (24,1%) участников исследования. Самую высокую смертность имели те, у кого уровень α-Kloto в плазме крови был самым низким <575 пг/мл. Самую низкую смертность имели те, у кого уровень α-Kloto в плазме крови был самым высоким >763 пг/мл. Более низкий уровень α-Kloto в плазме крови был связан с более старым возрастом, более низким кальцием в костях, более низким ЛПВП, более высокими триглицеридами и большим когнитивным ухудшением (www.ncbi.nlm.nih.gov/pubmed/21474560) -
2014, Университет Техаса научного центра здоровья в Сан-Антонио, США. Снижение чувствительности к инсулину приводит к развитию старческой слабости (потеря веса, истощение, снижение мышечной силы, снижение скорости ходьбы, низкая физическая активность), что повышает риск смертности. Метформин - препарат, который повышает чувствительность к инсулину и снижает маркеры воспаления независимо от снижения глюкозы при инсулинорезистентности.
В исследовании участвовали 2415 пациентов в возрасте от 65 до 90 лет с сахарным диабетом. Наблюдение длилось около 7 лет. Исследование показало, что если у пациентов была уже диагностирована слабость, то метформин практически не продлевал им жизнь, снижая смертность всего на 8% по сравнению с теми кто принимал сульфонилмочевину, что также было статистически не значимо. Но метформин продлевал жизнь пациентам с инсулинорезистентностью, у которых на момент начала исследования не была диагностирована слабость. Метформин предупреждал развитие слабости и снижал смертность на 30% за счет лечения инсулинорезистентности. При дальнейшем анализе подобных исследований оказалось, что если начать лечение метформином в более раннем возрасте, то это продлит жизнь пациентам с инсулинорезистентностью еще больше. Таким образом, если в анализах крови индекс инсулинорезистентности HOMA-IR: > 1,5 (ww.ncbi.nlm.nih.gov/pubmed/20200308), то лечение метформином может продлить жизнь. www.ncbi.nlm.nih.gov/pubmed/28441958
- 1999 год. Университетский Центр здравоохранения Estrie, Квебек, Канада. РКИ показало, что метформин у пациентов сахарным диабетом снижает маркеры окисления липидов в ЛПНП и ЛПВП (www.ncbi.nlm.nih.gov/pubmed/10421233). 2013 год, Университет Падуи, Италия. Повышенные уровни окисленых ЛПНП (oxLDL) ухудшают прогноз при сердечно-сосудистых заболеваниях в течение 7 летнего наблюдения (www.ncbi.nlm.nih.gov/pubmed/23102599). Однако после 65 лет маркер oxLDL не показывает реальный окислительный стресс. Вывод: если у вас есть инсулинорезистентность, и вам не больше 65 лет, и вы применяете лечение метформином, то снижение маркера oxLDL при терапии метформином указывает на эффективность лечения для снижения риска плохого прогноза ССЗ, а следовательно в этом случае метформин может продлить жизнь.
-
По данным многочисленных исследований, сердечно-сосудистые заболевания (ССЗ), в частности ишемическая болезнь сердца (ИБС) и ее осложнение – инфаркт миокарда (ИМ), остаются главной причиной смертности мужчин и женщин в индустриально развитых странах Европы, а также в США. Морфологической основой ИБС более чем в 95% случаев является атеросклероз коронарных артерий. В настоящее время получены доказательства важной роли воспалительных факторов в развитии и прогрессировании атеросклероза и его клинических проявлений. В настоящее время появляется все больше информации о новом неспецифическом биомаркере, относящемся к семейству цитокинов - ростовой фактор дифференцировки 15 (GDF-15), который может играть немаловажную роль в развитии и прогрессировании коронарного атеросклероза. GDF-15 (Growth differentiation factor 15 – GDF-15, macrophage-ingibitory cytokine 1 – MIC-1, плацентарный TGF-β, плацентарный костный морфогенетический белок – PLAB, простатический фактор – PDF) продуцируется в низкой концентрации такими органами, как мозг, печень, поджелудочная железа, в умеренных количествах – предстательной железой и в высокой концентрации – плацентой. GDF-15 является членом суперсемейства белков трансформирующего фактора роста β, которое включает в себя димерные полипептиды, участвующие в регуляции, дифференцировке и пролиферации клеток. Данный белок выполняет разнообразные функции: регулирует позднюю фазу активации макрофагов через ингибирование TNF-α, а также, обладая сильным противовоспалительным действием, ингибирует экспрессию рецептора липопротеидов очень низкой плотности, что тормозит перерождение макрофагов в пенистые клетки. https://cyberleninka.ru/article/n/rol-novyh-tsitokinov-rostovogo-faktora-differentsirovki-15-gdf-15-i-hryaschevogo-glikoproteina-39-ykl-40-v-razvitii-i-progressirovanii
Важно отметить, что его повышение может быть как положительным признаком, так и отрицательным. Так как GDF-15 защищает от воспаления и ингибирует экспрессию рецептора липопротеидов очень низкой плотности, то его уровень повышается при воспалительных процессах. А значит, чем активнее воспалительные процессы, тем выше GDF-15. При этом чем выше GDF-15, тем выше риск смертности не из-за высокого GDF-15, а из-за воспаления из-за которого GDF-15 повышается (www.ncbi.nlm.nih.gov/pubmed/20855664). Так если в анализах крови GDF-15 выше 1799 нг/мл, то повышается риск смертности от сердечно-сосудистых заболеваний из-за прогрессирования атеросклероза коронарных артерий (www.ncbi.nlm.nih.gov/pubmed/22065155).
С другой стороны искусственное повышение GDF-15 с помощью лекарств, без повышения воспаления, наоборот связано со снижением уровня смертности, так как GDF-15 играет защитную функцию. Именно поэтому в исследованиях повышение GDF-15 связано с повышением смертности, но в тоже время повышение GDF-15 с помощью метформина наоборот связано со снижением смертности. В частности применительно к метформину, повышение GDF-15 свидетельствует об эффективном применении метформина для защиты от сердечно-сосудистых рисков (www.ncbi.nlm.nih.gov/pubmed/30178545). Если пациент метформин не принимает, то рост GDF-15 свидетельствует о прогрессирующем воспалении, фиброзе и повышенном риске смертности. Если пациент начал принимать метформин, а GDF-15 стал выше, чем до приема метформина, значит метформина защищает данного пациента от повышенного риска смертности из-за сердечно-сосудистых заболеваний.
-
https://nestarenie.ru/wp-content/uploads/2014/10/1-3.png Исследования показали, что витамин К1 и К2 (МК-4) не снижают смертность. Но снижает смертность от ишемической болезни сердца и может продлить жизнь витамин К2 (МК-7) (www.ncbi.nlm.nih.gov/pubmed/15514282). Однако как сделать применение витамина К2 (МК-7) контролируемым в рамках будущей терагностики (Тераностика_про) старения? Витамин К2 (МК-7) дозозависимо снижает концентрацию dp-ucMGP (desphospho-uncarboxylated MGP) в плазме крови, вызывая карбоксилирование MGP, но не влияет на другие MGP белки (www.ncbi.nlm.nih.gov/pubmed/23062766). Карбоксилированный MGP блокирует кальцификацию артерий. Поэтому, когда наступает дефицит витамина К2 (МК-7), снижается уровень карбоксилированного MGP и повышается уровень некарбоксили рованного MGP (dp-ucMGP), что повышает кальцификацию артерий. dp-ucMGP может быть неинвазивным маркером статуса витамина К2 в организме, так как в крови уровень витамина К2 может быть высоким, а внутриклеточно недостаточным. РКИ 2015 года, Университет, Биопартнер, Нидерланды, 180 мкг витамина К2 (МК-7) в сутки у женщин в постменопаузе, применяемые 3 года, снизили уровень dp-ucMGP на 50% и улучшили эластичность артерий, но не изменили уровень воспалительных маркеров и некоторых других параметров. Это указывает на то, что основной механизм за счет которого витамин К2 (МК-7) снижает смертность и снижает жесткость артерий - это снижение dp-ucMGP до оптимального уровня. К тому же артерии становились эластичнее только у женщин, у которых была повышена их жесткость до начала исследования, что было связано с более высоким уровнем dp-ucMGP. У таких пациентов снижалась cfPWV (carotid-femoral and carotid-radial Pulse Wave Velocity, каротидно-бедренная скорость распространения пульсовой волны) - золотой стандарт определения жесткости артерий, хорошо связанный с рисками смертности. Важно, что в данном исследовании употребление витамина К2 (МК-7) снижает в сыворотке некарбоксилированный остеокальцин (маркер наличия витамина К в костной ткани) в такой же мере, как dp-ucMGP в крови. Это указывает на сопоставимое поглощение витамина К2 (МК-7) костной тканью и артериями. Эти результаты подтверждают связь между ССЗ и остеопорозом (www.ncbi.nlm.nih.gov/pubmed/25694037). На жесткость артерий влияют такие факторы как разрывы эластиновых волокон, накопление коллагена, фиброз, некроз медиальной гладкой мускулатуры, диффузия макромолекул в артериальной стенке, воспаление и кальцификация. Витамин К2 (МК-7) снижает кальцификацию - повышенный уровень dp-ucMGP повышает кальцификацию, а витамин К2 (МК-7) снижает его уровень. Максимальный эффект на карбоксилирование MGP, а значит снижение dp-ucMGP витамин К2 (МК-7) оказывает уже через год его регулярного применения.
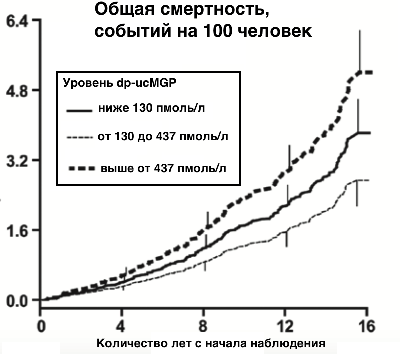 2015, Маастрихтский Университет, Нидерланды, в 15 летнем исследовании 2500 здоровых взрослых с применением менделевского анализа рандомизации, выяснилось, что чем выше уровень dp-ucMGP от оптимального, тем выше риск смертности (см. график внизу поста). Оптимальный уровень dp-ucMGP в анализах крови от 130 до 437 пмоль/л. (www.ncbi.nlm.nih.gov/pubmed/25421980). Также исследование 2017 года, показывает, что дефицит витамина К2 (МК-7), определяемый на основе повышенного dp-ucMGP выше, чем 500 пмоль/л, оказался у 31% людей в возрасте 53 ± 12 лет (особенно у мужчин). Так, что это не редкость. (www.ncbi.nlm.nih.gov/pmc/articles/PMC5748784). Важно отметить, что даже при достаточном потреблении витамина К2 может быть его дефицит, что показано в 2017 году, Университетом Тафтса, Бостон, США. Если маркер витамина К2 в клетках тканей сосудов dp-ucMGP больше 500 пмоль/л, то даже при нормальном употреблении витамина К2, наблюдается его дефицит, и стоит увеличить его дозу (www.ncbi.nlm.nih.gov/pubmed/28756183). Но возникает вопрос безопасности больших доз витамина К2 (МК-7). И как показывают исследования, прием витамина К2 не приведет к повышению активности прокоагулянта или к риску тромбоза. Вывод: если в анализах крови dp-ucMGP больше 500 пмоль/л - у пациента дефицит витамина К2 (МК-7), повышенный уровень кальцификации, сокращается продолжительность жизни. А дополнительный прием витамина К2 (МК-7) продлит жизнь таким пациентам, снижая риск смертности от ишемической болезни сердца. Если же в анализах крови dp-ucMGP меньше 130 пмоль/л, то нужно снижать употребление витамина К2 (МК-7) в рационе питания.
2015, Маастрихтский Университет, Нидерланды, в 15 летнем исследовании 2500 здоровых взрослых с применением менделевского анализа рандомизации, выяснилось, что чем выше уровень dp-ucMGP от оптимального, тем выше риск смертности (см. график внизу поста). Оптимальный уровень dp-ucMGP в анализах крови от 130 до 437 пмоль/л. (www.ncbi.nlm.nih.gov/pubmed/25421980). Также исследование 2017 года, показывает, что дефицит витамина К2 (МК-7), определяемый на основе повышенного dp-ucMGP выше, чем 500 пмоль/л, оказался у 31% людей в возрасте 53 ± 12 лет (особенно у мужчин). Так, что это не редкость. (www.ncbi.nlm.nih.gov/pmc/articles/PMC5748784). Важно отметить, что даже при достаточном потреблении витамина К2 может быть его дефицит, что показано в 2017 году, Университетом Тафтса, Бостон, США. Если маркер витамина К2 в клетках тканей сосудов dp-ucMGP больше 500 пмоль/л, то даже при нормальном употреблении витамина К2, наблюдается его дефицит, и стоит увеличить его дозу (www.ncbi.nlm.nih.gov/pubmed/28756183). Но возникает вопрос безопасности больших доз витамина К2 (МК-7). И как показывают исследования, прием витамина К2 не приведет к повышению активности прокоагулянта или к риску тромбоза. Вывод: если в анализах крови dp-ucMGP больше 500 пмоль/л - у пациента дефицит витамина К2 (МК-7), повышенный уровень кальцификации, сокращается продолжительность жизни. А дополнительный прием витамина К2 (МК-7) продлит жизнь таким пациентам, снижая риск смертности от ишемической болезни сердца. Если же в анализах крови dp-ucMGP меньше 130 пмоль/л, то нужно снижать употребление витамина К2 (МК-7) в рационе питания. -
Потребление магния 300 мг в сутки для женщин и 400 мг в сутки для мужчин рекомендуется ВОЗ для предупреждения многих заболеваний, снижения риска смертности от ССЗ и рака.
В 2008 году в Научно-исследовательском Институте в Окленде в США было показано, что дефицит магния снижает репликативную продолжительность жизни в культивированных фибробластах человека за счет влияния на механизмы апоптоза и за счет более быстрого истощения теломеров (www.ncbi.nlm.nih.gov/pubmed/18391207). К тому же дефицит магния сокращает продолжительность жизни крыс (www.ncbi.nlm.nih.gov/pubmed/894360). Метаанализ, оценивающий связь между магнием и риском сердечно-сосудистых событий, показал, что дефицит потребления магния с пищей через 4,8 лет наблюдения повышает риск смертности от ССЗ у людей в возрасте от 55 до 80 лет без ССЗ до начала наблюдения. А мужчины с более высоким уровнем (в пределах нормы) потребления магния имели на 50% более низкий риск смертности от рака. Магний играет ключевую роль в стабильности ДНК и влияет на механизмы апоптоза, в том числе возможно ингибирует экспрессию онкогена c-myc в раковых клетках. Дефицит потребления магния связан с повышением рисков сахарного диабета, воспаления, атеросклероза, гипертензии, остеопороза (www.ncbi.nlm.nih.gov/pubmed/24259558). Более высокие в пределах нормы уровни магния в плазме крови связаны со снижением смертности на 34% у пожилых людей старше 65 лет (www.ncbi.nlm.nih.gov/pubmed/26184299).Что же является основным пищевым источником магния?
Специи, орехи, крупы, какао и овощи являются богатыми источниками магния (https://ods.od.nih.gov/factsheets/magnesium-HealthProfessional/). Зеленые листовые овощи, также богаты магнием (https://medlineplus.gov/ency/article/002423.htm).Каков механизм повышения риска ССЗ, связанный с дефицитом магния? Магний предотвращает кальцификацию сосудов.
2012 год, Шарите, медицинская клиника IV, Берлинский Университет, Германия. Дефицит магния способствует усиленному притоку кальция в сосудистую ткань, приводя к отложению кальция в мягких тканях. Конечная стадия почечной недостаточности может служить моделью in vivo для исследования ускоренной кальцификации, при которой происходит усиленное отложение кальция в сосудах, индуцированное повышенным уровнем фосфата. Важно отметить, что у больных почечной недостаточностью чем ниже уровень магния в сыворотке крови, тем больше толщина КИМ сонной артерии и выше скорость распространения пульсовой волны, что указывает на более быстрое старение сосудов и повышенные риски смертности. Повышенные концентрации фосфатов в культурах клеток вызывают кальцификацию in vivo / in vitro в кольцах аорты крыс в присутствии щелочной фосфатазы. А ионы магния уменьшают in vivo/in vitro кальцификацию сосудов, несмотря на увеличенную концентрацию фосфата (www.ncbi.nlm.nih.gov/pubmed/22179063) (www.ncbi.nlm.nih.gov/pubmed/21750166)Добавки магния (БАД) могут снижать смертность у уремических крыс за счет снижения кальцификации, а также снижают кальцификацию у людей и остеопороз.
Важно понимать, что пищевой магний и уровень магния в крови могут быть маркером здорового питания, но не обязательно являться причиной снижения риска опасных заболеваний. Для точности нужно понимать влияют ли добавки магния в таблетках (в виде БАД) на те же риски. 2017 год, Научно-исследовательский институт по производству и развитию, Япония. Прием таурина с магнием снижает кардиометаболические риски у людей (www.ncbi.nlm.nih.gov/pubmed/28849518). 2016 год, медицинский факультет Нихонского Университета, Япония. Исследования ВОЗ в области ССЗ показывают, что прием таурина и магния снижают риск ССЗ. В исследовании изначально здоровые люди получали таурин (3 г в день) или магний 340 мг в день в течение 2 недель. Параллельно крысам линии вистар давали раствор таурина или магния в течение 4 недель. Было показано, что и добавки таурина и добавки магния значительно увеличили число колоний эндотелиальных клеток предшественников, что указывает на более активную работу стволовых клеток для регенерации сосудов. Таким образом достаточное потребление таурина и магния возможно может увеличивать продолжительность жизни путем предотвращать прогрессирования сердечнососудистых заболеваний (www.ncbi.nlm.nih.gov/pubmed/27412799). Исследование 2017 года, опубликованное испанскими учеными (Universidad de Cordoba). Чтобы определить, защищает ли пищевая добавка магния от развития сосудистой кальцификации, крысам линии вистар давали различные уровни магния, увеличивая содержание магния от 0,1 до 1,1%. Повышение уровня магния в питании крыс привело к снижению кальцификации сосудов, а также к лучшим показателям качества костной ткани для снижения риска остеопороза. Однако так работал только умеренно повышенный магний (0,3%), но не чрезмерно (от 0,6% и выше). Защитное влияние магния на кальцификацию сосудов не ограничивается его действием в качестве связующего фосфата в кишечнике, так как магний вводился внутрибрюшинно. А добавление магния через питание также уменьшило кровяное давление у крыс. У уремических крыс с установленной кальцификацией сосудов, повышение содержания магния внутрибрюшинно, уменьшило показатель смертности на 28-52%, что было связано с уменьшением сосудистой кальцификации (www.ncbi.nlm.nih.gov/pubmed/28760336). 2017 Отделение Нефрологии, эндокринологии и метаболизма, медицинский факультет Токайского университета, Япония. Пилотные исследования пациентов с ХБП показало, что добавки магния (в таблетках — в БАД) также замедляет сосудистую кальцификацию у людей, что потенциально может снижать смертность у людей, по аналогии с исследованиями на крысах. Следует также отметить, что магний непосредственно ингибирует секрецию паращитовидного гормона путем связывания с рецепторами паращитовидной железы, чувствительными к кальцию, что, в свою очередь, уменьшает количество остеокластов, как показано в текущем исследовании, а значит может защищать от остеопороза костей (www.ncbi.nlm.nih.gov/pubmed/29055421). В другом исследовании в 2010 году женщинам в постменопаузе ежедневно давали цитрат магния в течение 30 дней. В итоге был повышен уровень гормона остеокальцина в сыворотке крови и улучшены другие маркеры состояния костной ткани, что указывает на защитную роль магния от остеопороза костей (www.ncbi.nlm.nih.gov/pubmed/19488681)Но если дефицит магния повышает смертность, то его переизбыток также может повышать смертность.
Слишком высокий уровень магния сокращает продолжительность жизни коловратки (www.ncbi.nlm.nih.gov/pubmed/7428860).
2017 Отделение Нефрологии, эндокринологии и метаболизма, медицинский факультет Токайского университета, Япония. Передозировка магния связана с более быстрым снижением функции почек. Магний также ингибирует образование гидроксиапатита в кости, что при его переизбытке может привести к остеомаляции и может быть токсичным с точки зрения здоровья костей (www.ncbi.nlm.nih.gov/pubmed/29055421). 2017 Отделение Нефрологии, эндокринологии и метаболизма, медицинский факультет Токайского университета, Япония. Передозировка от диетических источников магния маловероятна у здоровых людей, потому что избыток магния в крови быстро фильтруются почками (https://ods.od.nih.gov/factsheets/magnesium-HealthProfessional/), а передозировка более вероятна при наличии нарушения функции почек. Несмотря на это, терапия высокими дозами магния является причиной смерти у детей раннего возраста (www.ncbi.nlm.nih.gov/pubmed/10654978) и тяжелой гипермагниемии, которая зафиксирована у одной пожилой женщины (www.ncbi.nlm.nih.gov/pubmed/15942092) и у одной молодой девушки (www.ncbi.nlm.nih.gov/pubmed/17726419), все они имели здоровые почки. Наиболее частыми симптомами передозировки магния являются тошнота, рвота и понос. Другие симптомы включают гипотензию, спутанность сознания, замедление сердечного и дыхательного ритма, недостатки других минералов, сердечная аритмия и даже смерть от остановка сердца (https://ods.od.nih.gov/factsheets/magnesium-HealthProfessional/)Даже при адекватном потреблении магния с пищей или в БАДах может быть его дефицит в организме.
Низкий уровень магния встречается у 2,5–15% от общей численности населения. С 2005 по 2006 год, 48 % людей в США потребляли меньше магния, чем рекомендовано ВОЗ (www.ncbi.nlm.nih.gov/pubmed/22364157). Дефицит магния может быть из-за чрезмерной потери магния через почки или желудочно-кишечный тракт, из-за алкоголизма, повышенного внутриклеточного сдвига. Так у пожилых людей всасывание магния из кишечника уменьшается, а почечная экскреция магния увеличивается с возрастом и от использования многих лекарств (ингибиторов протонной помпы, диуретиков и других). Большинство состояний дефицита магния протекают бессимптомно. Хронический дефицит магния наблюдается при сахарном диабете, при гипертонии (www.ncbi.nlm.nih.gov/pubmed/26069818)Даже при адекватном употреблении магния, его уровень в крови может быть недостаточным или чрезмерным. В обоих случаях повысится риск смертности. А значит употребление рекомендуемых ВОЗ 300-400 мг магния в сутки не всегда оправданно. Поэтому мы должны контролировать применение магния.
Мы должны не верить, а точно знать, что магний у нас в норме и блокирует кальцификацию. Для этого нужно измерять его уровень в анализах крови. Важно заметить, что добавки магния у людей с хронической почечной недостаточностью не повышали его уровень в клетках, но повышали уровень магния в крови, при этом блокируя кальцификацию сосудов. Данный факт говорит, о том, что достаточно измерять уровень магния в крови для определения эффективности его работы (www.ncbi.nlm.nih.gov/pubmed/29142966). Лучше всего следить, чтобы уровень магния в анализах крови точно не превышал 1,03 ммоль/л и желательно не снижался ниже 0.95 ммоль/л, но точно не был ниже, чем 0,73 ммоль/л.(www.ncbi.nlm.nih.gov/pubmed/3771947) (www.ncbi.nlm.nih.gov/pubmed/16704956) (www.ncbi.nlm.nih.gov/pubmed/24259558). В популяционном исследовании здоровья в Поморье с медианой наблюдения 10.1 лет, низкий сывороточного магния ≤0,73 ммоль/л оказался связан с более высоким риском смертности от всех причин и смертностью от ССЗ. А уровень магния с >0.95 ммоль/л связан с 29% снижением риска смертности от всех причин, но не от ССЗ (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4517021) -
2016 год, Тебризский Университет медицинских наук, Иран. Инсулин стимулирует пролиферацию эритроидных клеток-предшественников в культуре. Кроме того, внутривенная инфузия инсулина увеличивает транскапиллярный побег альбумина, тем самым уменьшая объем плазмы и увеличивая гематокрит. Таким образом рост гематокрита потенциально может служить маркером уровня инсулина в крови. В свою очередь высокие значения гематокрита увеличивают вязкость крови и ухудшают доставку кислорода и глюкозы в метаболически активные клетки ткани, что может усугубить функцию клеток при диабете 2-го типа. Поэтому снижение уровня гематокритита в крови до нормы — может выполнять защитную функцию и помогать в лечении диабета 2-го типа. И если есть средства, которые снижают повышенный гематокрит, вызванный инсулинорезистентностью, то такие средства могут быть полезными для лечения сахарного диабета. Именно поэтому исследовали из Тебризского Университета медицинских наук в РКИ изучали влияние 10 граммов инулина из цикория в сутки, обогащенного олигофруктозой на ферменты печени АЛТ и АСТ, на концентрацию в сыворотке крови кальция и фосфора, а также на гематокрит в общем анализе крови. В результате инулин из цикория значительно снижал показатели гематокрита и MCV (средний объем эритроцитов) в общем анализе крови (P < 0,05). В целом, учитывая положительные эффекты инулина и олигофруктозы по улучшению гомеостаза глюкозы, кальция, функциональных проб печени и для снижения артериального давления (www.ncbi.nlm.nih.gov/pubmed/26872721), добавка инулина рекомендуется при сахарном диабете 2-го типа в сочетании с другими лечебными мероприятиями (например, с лекарством метформин, которое может быть назначено только врачом).
Ссылка на исследование:
www.ncbi.nlm.nih.gov/pubmed/26872721
В подтверждение того, что гематокрит может являться маркером риска развития сахарного диабета 2-го типа из-за инсулинорезистентности рассмотрим исследование 2004 года от Национального Института диабета и заболеваний пищеварительного тракта и почек, США. Повышенный гематокрит ассоциирован с гипер-инсулинемией и является предиктором сахарного диабета 2-го типа. В данном исследовании гематокрит коррелировал с инсулином натощак и предсказывал заболеваемость диабетом у индейцев Пима независимо от возраста, пола, индекса массы тела, уровня креатинина в крови, курения и др. И это можно было корректировать изменяя показатели инсулина натощак. Высокий гематокрит, в отсутствии основного гематологического или медицинского разлада, может быть результатом повышенных уровней инсулина и отражать сопротивление инсулина — снижение чувствительность к инсулину (индекс инсулинорезистентности HOMA-IR). Поэтому, если в анализах крови повышен и гематокрит и HOMA-IR одновременно, то это говорит о повышенном риске сахарного диабета в будущем, а снижение гематокритита, помимо снижения HOMA-IR может быть дополнительной мишенью для лечения инулином, как мы увидели в исследовании 2016 года от Тебризского Университет Медицинских наук, Иран (www.ncbi.nlm.nih.gov/pubmed/26872721)Ссылка на исследование:
http://care.diabetesjournals.org/content/27/9/2245.long
-
Некоторые пьют глюкозами сульфат и думают, что он им как-то помогает. Но помогает ли ли, от чего, не вредит ли? Глюкозамин подкупает тем, что он продлевал жизнь животных и был связан со снижением смертности у людей. Но как сделать его применение контролируемым?2009 год, Университет Северной Каролины. Глюкозамин (лучше сульфат) в исследованиях на людях снижал риски смертности от колоректального рака и рака легких, возможно за счет снижения воспаления (www.ncbi.nlm.nih.gov/pubmed/19423520). Однако точный механизм ранее не был установлен. Но, например, в исследовании Центра исследования рака Фреда Хатчинсона, США от 2015 года было установлено, что глюкозами в пилотном исследовании в дозировке 1500 мг в сутки в РКИ на людях с индексом массы тела 25.0–32,5 кг/м2в течение 28 дней в возрасте 20-55 лет снижал С-реактивный белок на 23% (www.ncbi.nlm.nih.gov/pubmed/25719429) (www.ncbi.nlm.nih.gov/pubmed/22828954). То, что глюкозамин может снижать смертность от рака за счет снижения уровня С-реактивного белка выглядит вполне правдоподобным, так как, например, повышение показателей С-реактивного белка от 1 до 5 мг/л в анализах крови линейно увеличивают риск рака лёгких в 3-5 раз — в зависимости от показателей VO2max (www.ncbi.nlm.nih.gov/pubmed/26008754).Поэтому, если С-реактивный белок выше 1 мг/л и нет противопоказаний (не повышен HOMA-IR в анализах крови www.ncbi.nlm.nih.gov/pubmed/17570985 и др.) к применению глюкозами сульфата, то терапия этим веществом в дозировке 1500 мг в сутки может снижать смертность от рака и общую смертность (https://academic.oup.com/ajcn/article/91/6/1791/4597416) за счет снижения воспаления, которое отразится в снижении маркера воспаления С-реактивный белок, как ожидается примерно на 23%.Важно заметить, что глюкозамин сульфат вероятно способен продлевать жизнь особенно пожилым мышам и людям, что довольно ценно. Так глюкозамин продлевал жизнь уже очень старым мышам (www.ncbi.nlm.nih.gov/pmc/articles/PMC3988823). А в исследовании 2010 года от Вашингтонского Университета, США было исследовано (среди 77 673 участников) применение 13 диетических добавок у пожилых людей, включая глюкозамин, в 10 летнем исследовании. Интересно, что ни Пальметто, ни β-каротин, ни гибко билоба, ни чеснок, ни селен, ни рыбный жир, ни другие витамины и минералы, а также поливитаминные комплексы, участвующие в данном исследовании не снижали смертность пожилых людей, а некоторые из них даже повышали. Рыбный жир повышал риски, если применялся чаще, чем 3 раза в неделю. И только глюкозамин и хондроитин были связаны со снижением общей смертности. В исследовании участвовали жители штата Вашингтон в возрасте от 50 до 76 лет (www.ncbi.nlm.nih.gov/pubmed/20410091)
Как управлять жесткостью матрикса. "Tissues stiffen during aging and during the pathological progression of cancer, fibrosis, and cardiovascular disease.
Extracellular matrix stiffness is emerging as a prominent mechanical cue that precedes disease and drives its progression by altering cellular behaviors.
Major drivers of changes to the mechanical properties of the extracellular matrix include phenotypically converted myofibroblasts, transforming growth factor-beta (TGF-beta), and matrix cross-linking.
Here, we discuss mechanisms that cause ECM stiffening during natural aging and pathological progression. Therapeutic approaches to prevent or reverse matrix stiffening, including their clinical relevance, are described."
Lampi, M. C. & Reinhart-King, C. A. Targeting extracellular matrix stiffness to attenuate disease: From molecular mechanisms to clinical trials. Sci Transl Med 10, doi:10.1126/scitranslmed.aao0475 (2018).
https://www.ncbi.nlm.nih.gov/pubmed/29298864
Von Haehling, S. et al. Mid-regional pro-adrenomedullin as a novel predictor of mortality in patients with chronic heart failure. European Journal of Heart Failure 12, 484–491 (2010).
https://www.ncbi.nlm.nih.gov/pubmed/20215339
Odermatt, J. et al. Pro-Adrenomedullin predicts 10-year all-cause mortality in community-dwelling patients: a prospective cohort study. BMC Cardiovascular Disorders 17, (2017).
https://www.ncbi.nlm.nih.gov/pubmed/28676115
Обязательно оставляйте свои комментарии под статьей, которую Вы читаете. Это очень важно для нас.
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить. Обязательно оставляйте свои комментарии под статьей, которую вычитаете. Это очень важно для нас.

Автор статьи
Веремеенко Дмитрий Евгеньевич
Телефон:
Почта:
Сфера деятельности - data science в медицине
Основатель проекта, изучающего терапии, направленные на увеличение продолжительности жизни человека (nestarenie.ru/slb-expert_.html)
Со-основатель IT сервиса продления жизни
Основатель форума о продлении жизни Nestarenie Camp (nestarenie.ru/camp.html)
Со-автор книги "Бонусные годы" (nestarenie.ru/kniga-3.html)
Создатель справочного блога о старении человека (nestarenie.ru)
Социальные сети:
- Карта Viza (доллары): 4215 8901 1587 0138 для переводов за пределами РФ
- Карта МИР в Сбере (рубли): 2202 2032 1501 6686 (МАЙЯВИ Ч.) - на территории РФ
Свежие комментарии
Подпишитесь на свежие статьи
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить.
4 комментария
“Как управлять жесткостью матрикса”
——————————————-
Дорогой Дмитрий, интересно
Соотношение магния и кальция в крови
будет существенно влиять на жесткость матрикса?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
нет
Глюкозамин отдельно принимать или с хондроитином?
В обычном желатине есть глюкозамин?