Дата создания: 31 октября 2018
Обновлено: 27 июня 2021
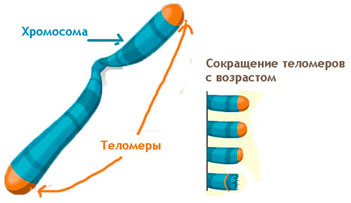
Виноваты ли теломеры в старении?
 Казалось бы, «включение» теломеразы во всех клетках может сделать клетку бессмертной. Однако вскоре возникли опасения в связи с тем, что активный синтез теломеразы наблюдается и в 90% раковых опухолей. Встал вопрос: не приведет ли активация теломеразы к риску злокачественной трансформации?
Казалось бы, «включение» теломеразы во всех клетках может сделать клетку бессмертной. Однако вскоре возникли опасения в связи с тем, что активный синтез теломеразы наблюдается и в 90% раковых опухолей. Встал вопрос: не приведет ли активация теломеразы к риску злокачественной трансформации?
Кроме того, оказалось, что старение клеток далеко не всегда сопровождается сокращением теломеров. Например, в случае эпителиальных клеток слизистой полости рта или роговицы глаза человека. Это говорило о том, что активация теломеразы не остановит старение.
Перед тем как перейти к генной терапии, эффекты теломеразы исследовались на трансгенных мышах. Оказалось, что если постоянно «активирован» ген TERT во всех клетках мыши, то может повышаться и риск рака у мышей.
ncbi.nlm.nih.gov/pubmed/12034875
ncbi.nlm.nih.gov/pubmed/27784441
У мужчин теломеры были значительно длиннее, чем у женщин, однако мужчины живут меньше женщин. В данном исследовании не найдено никаких доказательств значимой связь между длиной теломер в возрасте 70 лет и ухудшением памяти, скоростью обработки информации в возрасте 70 лет, или когнитивными нарушениями в возрасте от 11 до 70 лет. Нет доказательств связи между длиной теломер и результатами измерений физического здоровья. Данное исследование не поддерживает гипотезу о том, что длина теломеров является полезным показателем биологического возраста в здоровой пожилой популяции. Это исследование показывает, что длина теломер не является достаточной для того, чтобы быть маркером незначительных различий в когнитивных изменениях в течение жизни между членами относительно здоровой 70 — летней популяции. Когнитивные способности в молодости не предсказывали длину теломер в возрасте 70 лет. Преимущества этого исследования заключались в большой выборке, а также в возрастной, этнической и географической однородности выборки, в наличие когнитивных оценок за 60 лет до 70 летнего возраста участников - в возрасте 11 лет.
ncbi.nlm.nih.gov/pubmed/21194798
Много лет уже пытаются рассматривать теломеры, как биомаркер старения, но до сих пор нет доказательств. Самый свежий обзор 2017 года делает заключение, что длина теломеров лейкоцитов не связана с продолжительность жизни. Физическая активность хорошо ассоциирована с продолжительностью жизни, но связь между физической активностью и длиной теломеров не подтверждается в 50% исследований, что также ставит под сомнение ассоциации длины теломеров с продолжительностью жизни людей.
ncbi.nlm.nih.gov/pubmed/29186077
Клетки тетраурелии парамеции имеют ограниченный клональный жизненный период и умирают примерно после 200 делений. Однако их теломеры не сокращаются. После примерно 200-от делений их ДНК накапливают много ошибок, и клетка погибает. Поэтому кажется, что теломеры не могут сделать нас бессмертными.
ncbi.nlm.nih.gov/pubmed/8127914
Чем грозят ошибки в ДНК при бесконечно делящихся ДНК, не ограниченных теломерами в количестве делений? В клетке происходит до 1 000 000 повреждений на клетку в день. Если ремонт не сработал, и механизмы самоуничтожения клетки не сработали, то возникают повреждение ДНК – ошибки и мутации (www.ncbi.nlm.nih.gov/pubmed/5055816) (www.ncbi.nlm.nih.gov/pubmed/5106728) В отличие от мышей мы живем гораздо дольше. Тем важнее наши клетки защищать лучше от мутаций. В 107 году в Университете Джона Хопкинсона показали, что 66% всех видов рака у людей случаются в результате мутаций. В отличии от мышей, у людей гораздо больше времени на их возникновение (science.sciencemag.org/content/347/6217/78)
Большинство механизмов, которые сильно продлевали жизнь, защищают ДНК от поломок (www.ncbi.nlm.nih.gov/pubmed/15589490):
1. 2016 Токийский медицинский и стоматологический Университет. Старение волосяного фолликула и потеря волос из-за повреждения ДНК в стволовых клетках (www.ncbi.nlm.nih.gov/pubmed/26912707) 2. Генетическая сверх экспрессия BubR1 защищает ДНК, увеличивает максимальную продолжительность жизни трансгенных мышей на 15% и значительно снижает частоту опухолей. Когда экспрессия гена BubR1 снижается, хромосомы не могут правильно разделиться во время митоза. Американские ученые из клиники Майо в Рочестере, штат Миннесота — трансгенные мыши с повышенной экспрессией BubR1. В этом исследовании одна из групп мышей подвергалась воздействию веществ, необратимо вызывающих опухоли легких и кожи (www.ncbi.nlm.nih.gov/pubmed/23242215). 3. Генетическая сверх экспрессия MTH1 увеличивает продолжительность жизни у трансгенных мышей на 22% в сравнении с мышами дикого типа. 2013 год (Италия). Белок MTH1 участвует в ремонте повреждений ДНК и РНК. У мышей геномные повреждения с возрастом накапливались гораздо меньше, так как они живут короче. Поэтому они могут позволить себе немного поудлинять теломеры (www.ncbi.nlm.nih.gov/pubmed/23648059). 4. Активность ядерного фермента PARP1 возрастает в 500 раз и более при связывании с участками разрыва ДНК (ремонтирует ДНК). PARP1 в лейкоцитах клеток коррелирует с МПЖ вида (www.ncbi.nlm.nih.gov/pubmed/1465394). 6. После активации митогеном или антигеном T и B лимфоциты превращаются в лимфобласты. В лимфобластах долгожителей (100 лет и старше) значительно выше активности PARP1, чем в клеточных линиях молодых людей (от 20 до 70 лет) (www.ncbi.nlm.nih.gov/pubmed/9587069). 7. В клетках пожилых людей (69 до 75 лет) PARP1 и PARP2 уменьшаются в 2 раза в сравнении с молодыми (от 19 до 26 лет). Но у долгожителей (от 100 до 107 лет) экспрессия PARP1 на уровне молодых людей (www.ncbi.nlm.nih.gov/pubmed/17518695).
Мутации многих генов, которые участвуют в ремонте или метилировании ДНК сильно сокращают жизнь:
1. Ген Ercc1 участвуют в восстановлении повреждений ДНК. Мыши с дефицитом гена Ercc1 (Ercc1∆/-) показывают многочисленные функции ускоренного старения. Сокращение калорий на 30% у таких мышей продлевает жизнь в 3 раза (www.ncbi.nlm.nih.gov/pubmed/27556946). 2. Долгожители от 100 до 107 лет — более высокие ферменты ремонта ДНК (PARP1 и Ku70) чем у 69-75 летних. 3. Мыши Ku70 -/- быстро стареют и умирают (www.ncbi.nlm.nih.gov/pubmed/21600302)(www.ncbi.nlm.nih.gov/pubmed/17518695) (www.ncbi.nlm.nih.gov/pmc/articles/PMC2169178). 4. Канада 2003 год. Люди с синдромом Вернера (прогерея взрослых) быстро стареют и имеют дефицит PARP1 (www.ncbi.nlm.nih.gov/pubmed/12707040). 5. Мыши с мутацией Ku70 имеют больше мутаций в ДНК и сильно меньше живут (www.ncbi.nlm.nih.gov/pubmed/10485901) (www.ncbi.nlm.nih.gov/pubmed/16439206) 6. 2011 год, Университет Ливерпуля, Великобритания. Накопление повреждений ДНК с возрастом является важной причиной старения. А Генетические манипуляции с путями репарации ДНК у мышей, еще более укрепляют эту гипотезу. У человека и у других млекопитающих, повреждение ДНК происходит от 25 до 115 раз в минуту в каждой клетке (www.ncbi.nlm.nih.gov/pubmed/21600302) (www.ncbi.nlm.nih.gov/pubmed/10792040).
В связи с эти помним, что лимит Хейфлика (сокращение теломеров при каждом делении) является проявлением механизма, возникшего у многоклеточных организмов для защиты от мутаций. Чтобы на место старых потенциально мутантных клеток приходили новые, созданные стволовыми клетками организма. Иначе организм просто погибнет. При каждом делении клеток происходит репликация ДНК, что повышает количество соматических мутаций. Одна мутантная клетка должна дать миллионы потомков, чтобы редкие мутационные события встретились в опасном сочетании. Если просчитать вероятность накопления критического количества мутации, то у человека получается примерно 20-40 клеточных делений на одну мутацию. Одной клетке требуется примерно от 4 до 6 мутаций для превращения в раковую. Таким образом ограничения общего количества делений до 100 достаточно, чтобы предотвратить появление раковых клеток. В результате эволюции наши предки лишь немногие жили дольше 30-40 лет из-за болезней и давления хищников. В результате эволюция нашла баланс между заменой клеток и пролиферацией. Это привело к ограничению числа деления клеток на уровне 50-80 для фибробластов в культуре клеток, что соответствует возрасту 40 лет без лишнего запаса делений.
Когда ДНК мутирует, то она все хуже работает. Повреждения копятся. Такую клетку нужно заменить на новую. Поэтому теломеры «говорят»: "Стоп, пора умирать и дать место новой клетке, рожденной из стволовой". Но если теломеры более длинные, то мутации в ДНК копятся больше, и теоретически клетка должна становиться старее. И действительно — на сегодняшний день "золотым стандартом" определения скорости старения являются эпигенетические часы Хорвата, основанные на оценке метилирования. Исследователи из нескольких учреждений, включая UCLA, Бостонский Университет, Стэнфордский Университет и Институт исследований старения на иврите SeniorLife, проанализировали образцы крови из почти 10 000 человек. Генетические маркеры в гене, ответственном за сохранение теломеров, не связаны с более молодым биологическим возрастом людей. (Мое примечение: Люди не крысы, Если бы все дело было в теломерах, то крысы жили бы в 60 раз дольше людей, так как их теломеры в два раза длиннее). И вот, варианты в гене TERT на хромосоме 5, которые связаны с более старым эпигенетическим возрастом, также были связаны с более длинными теломерами. Это указывает на критическую роль гена TERT в регулировании эпигенетических часов.
Вывод. Не смотря на то, что крысы с чуть-чуть более длинными теломерами, удлиненными в позднем возрасте, могут прожить немного дольше, эти же крысы при этом похоже быстрее эпигенетически стареют.
eurekalert.org/pub_releases/2018-02/hsif-gwa020218.php
Обязательно оставляйте свои комментарии под статьей, которую Вы читаете. Это очень важно для нас.
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить. Обязательно оставляйте свои комментарии под статьей, которую вычитаете. Это очень важно для нас.

Автор статьи
Веремеенко Дмитрий Евгеньевич
Телефон:
Почта:
Сфера деятельности - data science в медицине
Основатель проекта, изучающего терапии, направленные на увеличение продолжительности жизни человека (nestarenie.ru/slb-expert_.html)
Со-основатель IT сервиса продления жизни
Основатель форума о продлении жизни Nestarenie Camp (nestarenie.ru/camp.html)
Со-автор книги "Бонусные годы" (nestarenie.ru/kniga-3.html)
Создатель справочного блога о старении человека (nestarenie.ru)
Социальные сети:
- Карта Viza (доллары): 4215 8901 1587 0138 для переводов за пределами РФ
- Карта МИР в Сбере (рубли): 2202 2032 1501 6686 (МАЙЯВИ Ч.) - на территории РФ
Свежие комментарии
Подпишитесь на свежие статьи
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить.
108 комментариев
Спасибо, но формально по ИНВИТРО все в норме:
Железо 20.07 мкмоль/л (референс 11.6 – 31.3)
Ферритин 92 мкг/л (референс 20 – 250)
Дмитрий, можно ли пониженный уровень лимфоцитов поднять сывороточным протеином (спортпит)?
Читал в Интернете, что белок очень лимфоцитам нужен для самовоспроизводства, нужно очень много белка есть, чтобы уровень поднялся.
У меня в расширенном ОАК (Инвитро) только одна красная метка – лимфоциты (авс) чуть ниже нижней границы, а лимфоциты в % (процентах) всегда норма. ОАК я делаю раз в 2 месяца, такая ситуация уже почти пол года.
______________________________
30 августа
Лимфоциты, абс. 0.90 (норма 1.32 – 3.57)
______________________________
6 октября
Лимфоциты, абс. 1.28 (норма 1.32 – 3.57)
______________________________
3 декабря
Лимфоциты, абс. 1.10 (норма 1.32 – 3.57)
_______________________________
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Лимфоциты понижаются при дефиците железа.
Прикольная статья. В отличает от статьи 2017 года про тестостерон и старение. Тут много разумных доводов и много адекватных первоисточников. Благодарю вас за труды!
Я наткнулась на статью. В ней говорится:
Обратить старение вспять удалось и американским медикам из Хьюстонского методистского исследовательского института. Они с помощью РНК-терапии удлинили теломеры в клетках, взятых у детей, больных прогерией — редким генетическим заболеванием, вызывающим преждевременное старение организма.
У таких пациентов теломеры — насадки, расположенные на концах хромосом и обеспечивающие репликацию (удвоение) ДНК, — от рождения очень короткие, из-за чего эти люди начинают стареть еще в детстве.
Из этого следует что дети с болезнью прогерии старели все таки из за коротких теломеров?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Нет. Из этого не следует. Прогерия – это не старение, а просто похожа на старение, однако не старение. Укорочение теломер не имеет отношения к старению. И их удлинение не известно, как скажется на здоровье и долголетие. Более того, что дольше живет вид животногоч тем короче у него теломеры. У людей теломеры короче, чем у мышей в 2 раза
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Вот так делаются сенсации на пустом месте
https://telegra.ph/Biologicheskij-process-stareniya-cheloveka-vpervye-podvergsya-izmeneniyam-11-19
Типа омолодили
Вот только жизнь им все равно не продлят и морщины никуда не денутся. Зато порадуются омоложению
Есть еще более важные связи в поведении генетических клеточных механизмах. На мой взгляд наиболее важным причинно-следственным элементом является отсутствие или наличие необходимости умирания организмов после проживания некоего условного периода времени. Если нет ограничений в пищевых ресурсах, то генетические ограничения длитеьности жизни поведут себя по-другому. Они будут реализовать зависимость длины жизни от иных факторов. Что это реально значит сейчас, говорить не буду.. Каждый сможет додумать сам.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
ncbi.nlm.nih.gov/pubmed/31444995
Наследуемая длина теломер связана с повышенным риском рака и сниженным риском ишемической болезни сердца, но имеет незначительное влияние на другие возраст-зависимые заболевания. Удлинение теломер не имеет пользы для здоровья, но может привести к росту риска раковых заболеваний.
прочитал предыдущие выписки и понял, что попал не туда. если мне предсказывают продолжительность жизни не более 100 лет и при этом не пояснив в деталях. так что я продолжу свою работу в этом направлении, а время покажет. для тех, кто хочет задержать старе-ние, напомню, что оно зависит от очень большого количества факторов здоровья и только применяя многие из них можно увидеть результат. с уважением ко всем мечтателям, Владимир.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
исследований. Отрезайте у ссылок http:
ncbi.nlm.nih.gov/pubmed/31444995
Наследуемая длина теломер связана с повышенным риском рака и сниженным риском ишемической болезни сердца, но имеет незначительное влияние на другие возраст-зависимые заболевания. Удлинение теломер не имеет пользы для здоровья, но может привести к росту риска раковых заболеваний.
прочитал статью о теломерах, т.к. меня давно интересовал а тема долголетия и я делал для этого всё, что мог найти и понять. немного успел применить к своей маме и она прожила 98.5 лет. а сейчас я применяю эти и новые знания для себя. мой возраст полный 83 г.
давно использую тесты по системе биолокации и др. для проверки своего здоровья и контроля долголетия. результаты такие: Индекс
Здоровья (интегральный показатель состояния всех органов и систем) сейчас равен 98-100 %, а показатель долголетия показывает 140-145 лет. хотелось бы от специалистов получить советы по долголетию и продолжить дальнейшую практику.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Человек, как вид неспособен прожить более 120 лет. А 99,999% не способны прожить более 95-100 лет.
И женщины живут в России лет на 10 дольше. Значит Вы можете претендовать на 88, и если очень постараетесь, то также как и мама.
Вот ещё интересная информация…
Вот график синтеза коллагена с возрастом archive.li/if3nH/2449b4b38988afc30a0e1676b8cf1858c3ccd7c2.jpg
из него видно, что синтез коллагена начинает падать после прекращения роста и к старости матрикс очень слабый,так как коллагена почти нету, и ему не из чего строиться…Также есть информация, что при диете с метионином жизнь сокращается из того, что для его метаболизма нужен глицин,который также необходим для синтеза коллагена,из-за этого страдает коллаген …и при одновременном сочетании глицина и метионина жизнь не сокращается fasebj.org/doi/abs/10.1096/fasebj.25.1_supplement.528.2
Также полно информации, что предотвращения падения коллагена продлевает жизнь (при помощи генов,фармпрепаратов и тд) researchgate.net/publication/269772508_Dauer-independent_insulinIGF-1-signalling_implicates_collagen_remodelling_in_longevity
telegraph.co.uk/news/health/news/11295136/Drugs-that-smooth-away-wrinkles-could-boost-longevity.html
только повышать коллаген не за счет гормона роста,так как он наносит больше вреда, чем пользы(повышает сахар,делит клетки и тд)
Вот график гиалуроновой кислота в зависимости от возраста
nubo.com/news/tag/hyaluronic-acid-serum/
которая продлевала жизнь генным мышам с повышенным её содержанием в отличии от контроля…
Вот создали бы таких мышей с достаточным уровнем гиалуроновой кислоты, эластина, коллагена и и малых протеогликанов (декорина и тд) которые правильно строят коллаген,и чтоб не давали снижаться всему этому по мере старения и посмотреть что произойдет с продолжительностью жизни, и с теми же сшивками…
Надо ещё понять почему коллаген сшивается даже в среде без микробов ,физического воздействия и тому подобного…может влага из него испаряется или что-то другое,почему в какой-то момент происходит сшивка…просто так ничего не бывает,это следствие чего-то…
А что если сшивки коллагена организм сам делает,так как старые фибробласты делают слабый матрикс,который буквально рассыпается,а сшивки его поддерживают
Ещё вопрос в том,что сшивки ли больше портят матрикс, или то что старые фибробласты его плохо строят с самого начала при обновлениях коллагена…
Читал, что в стволовых клетках с возрастом накапливаются белки,которые делают эти клетки неактивными и они перестают обновлять ткани…Интересно белки накапливаются из-за воздействия старого матрикса или по другой причине, также не являются ли эти белки своеобразной защитой от рака ,так как со временем в стволовых клетках накапливаются ошибки от многократных делений…Ещё бы узнать как при рождение начинает строиться новый матрикс с нуля и каким образом организм знает какого размера,формы,структуры,скорости обновления матрикс должен быть
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
О каких белках речь идет?
вот статья про белки
https://naked-science.ru/article/sci/uchenye-vernuli-molodost-stvolovym
вот про глюкозепан
http://longevityreporter.org/blog/2015/11/8/undoing-sugar-damage-first-synthesis-of-culprit-glucosepane
Получается что тот же глюкозепан образуется в определенных местах, где ему благоприятствует среда…
значит можно сделать выводы где глюкозепан не образуется (или медленнее образуется), и что в этом месте ему не даёт образовываться
Ещё вот интересно, все мы произошли из стволовой клетки, которая может делиться бесконечно, но как она узнаёт что ей надо не просто делиться, а в какой-то момент превратиться в обычную с ограниченным делением…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
ИЗ информации записанной в ДНК, а также из информации из вне от внеклеточной среды.
Дмитрий,ведь при постройке внеклеточного матрикса тоже что-то управляет этим процессом…какая структура будет,какого размера будет внеклеточный матрикс органа, с какой скоростью происходит обновления матрикса и тд…только вот что за это отвечает?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Ферментативное гликирование – процесс перманентный и неуправляемый. Ферментативный гликированием уже управлять можно.
Дмитрий, Вы пишите, что: “Клетки тетраурелии парамеции имеют ограниченный клональный жизненный период и умирают примерно после 200 делений. Однако их теломеры не сокращаются. После примерно 200-от делений их ДНК накапливают много ошибок, и клетка погибает. Поэтому кажется, что теломеры не могут сделать нас бессмертными.
ncbi.nlm.nih.gov/pubmed/8127914”
Можно подумать, что клон гибнет из-за ошибок ДНК, но в статье, как я понял, этого не утверждается.
Дмитрий, встречал информацию, что белки теплового шока продлевали жизнь,также что они влияют на внеклеточный матрикс (на ММП-2 и коллаген),что думаете на этот счет
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Действие на белки теплового шока – это митогормезис, который продлевает жизнь, любой митогормезис продлевая жизнь замедляет старение матриска.
Дмитрий,нашел интересную статью про матрикс
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4659457/
из неё как я понял,что есть хорошие сшивки коллагена,а есть плохие…и например что глюкозепан находится в местах где не работает ферменты разрушающие старый коллаген и есть какая-то связь с белками теплового шока и прочим…
Дмитрий, спасибо за статью. Есть ли панели или тесты, чтобы измерить эпигенетические маркеры? И есть ли какие-то доказанные эпигенетические маркеры?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Эпигегетические маркеры малополезны.
При стимуляции коллагена, как важно, чтобы коллаген не просто синтезировался, но чтобы он правильно собирался, был корректно оформлен. Иначе коллагеновые волокна получатся разной толщины, разной длины и хаотично ориентированные в пространстве.
Это не позволит им правильно встроиться в дерму, и пользы от стимуляции коллагенеза будет мало.Помимо эластина на процесс сборки коллагена влияют малые протеогликаны.
Малые протеогликаны – сложные белки, состоящие из белка и длинных полисахаридных цепей, гликозаминогликанов, с низкой молекулярной массой. Они содержатся в хрящах, сухожилиях, связках, менисках, коже и других видах соединительной ткани.
Наиболее изучены декорин, бигликан, фибромодулин, люмикан, перлекан.
С возрастом падает синтез коллагена и веществ, которые его правильно строят в внеклеточном матриксе…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
С возрастом падает синтез коллагена так как его чрезмерный синтез в возрастом уже чреват фиброзом. А чтобы он правильно собирался (я только предполагаю) нужно разрушить старый, который сшит. Иначе он нарушает всю структуру
Я уже писал своё предположение (почему-то Вы не обратили на это внимание), что пространственной структурой коллагена заведуют фибробласты. Они выстраивают его, можно предположить, по матрице своего цитоскелета. Сшивки образуются, как я понимаю, при ошибках ориентации коллагеновой матрицы. Следовательно, виноваты фибробласты! Думаю, ошибкой было бы полагать, что сложная матрица синтезируется сама по себе без заданной программы.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Я читал ряд исследований по хранению на складе материалом из коллагена, используемых для строительных целей. Так в нем нет никакой программы. А коллаген в нем сшивается сам по себе по мере хранения.
Сшивается то, сшивается… только ведь в них заложен информация на чистку старого и созданием нового матрикса(я про фибробласты), тобишь они могут изменять коллаген… Другое дело что процесс медленный и надо его улучшать(чистку старого матрикс)
И старые фибробласты плохой матрикс создают(слабый и возможно с большим количеством сшивок), поэтому и их надо омолаживать
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Сшивки образуются и в мертвой ткани без участия клеток
Если коллагеновые фибриллы кое-как расположены, то естественно они сшиваются, и сшиваются даже в мертвой ткани. Но чтобы они были расположены в матриксе кое-как должен нарушиться механизм их ИДЕАЛЬНОГО расположения, которым как раз заведуют фибробласты. И все проблемы начинаются, только тогда, когда постройка пространственной структуры коллагена начинает происходить с ошибками, а ошибки происходят из-за фибробластов, которые стареют. Можно предположить, что сначала это случайные ошибки (в детстве их довольно много, но тогда всё синтезируется, надо делать скидку на это), а потом уже закономерные – из-за дисфункции фибробластов (при том, что коллаген заново не синтезируется, а только обновляется, сшивок образуется примерно столько же). После этого, матрикс-коллаген уже почти не обновляется, а только лишь стареет – это заключительная фаза, когда старениЕ матрикса уже не зависит от дисфункции фибробластов, потому что они уже даже не могут зацепиться, не говоря уже о том, что они сами по себе уже стары и менее активны.
Дмитрий ,получается если поместить стволовую клетку в молодой матрикс,то она живет вечно,если матрикс не будет стареть…такое ведь возможно сделать в пробирке…при сильной репарации днк от ошибок и сильных генах против рака…то бишь сделать такое исследование с нестареющим матриксом и стволовой клеткой…я как понимаю ,что стволовые клетки при старом матриксе плохо работают…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Гипотетически да
Возможно старение каждого последующего поколения клеток запрограммировано в геноме. Пока таких данных не поступало, но это не значит, что это не так. А укорачивание теломер это уже терминальная стадия, как следствие общей программы старения клеточной линии.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Стволовые клетки способны омолаживаться.
Не понимаю откуда у Вас такая уверенность. Те некоторые работы пока что трудно воспринимать всерьез.
Это было бы фундаментальное открытие в биологии, Вы же предлагаете верить каким-то сомнительным статьям…
Дмитрий Вы пишите, что: “Кроме того, оказалось, что старение клеток далеко не всегда сопровождается сокращением теломеров. Например, в случае эпителиальных клеток слизистой полости рта или роговицы глаза человека. Это говорило о том, что активация теломеразы не остановит старение.” Вот, пожалуйста, подтверждение моей теории. Можно конечно сказать, что виноват матрикс и прочие факторы…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Давно еще Оловников предположил, что «счетчиком» являются теломеры — кончики хромосом, которые укорачиваются при каждом делении. А в половых и раковых клетках это укорочение предотвращает особый фермент — теломераза.
В 90-е годы XX века теломераза была найдена, укорочение теломер подтвердилось. Но оказалось, что непосредственной причиной старения оно не является. Тогда Оловников предложил новую гипотезу: о существовании принтомер — особых ДНК, в которых содержится «память» о специализации клетки. Все вместе они составляют парагеном, укорочение которого и приводит к старению. Сейчас Оловников ищет возможность подтвердить справедливость этой гипотезы в экспериментах.
rg.ru/2010/02/18/reg-ural/dolgoletie.html
Вполне возможно и принтеры будут опровергнуты. Так, что никаких фундаментальных открытий в теломерах нет. Просто промежуточная гипотеза. И ни один серьезный ученый теломеры в качестве причины старения уже не воспринимает.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Это не фундаментальное открытие. Лимит Хейфлика – это открытие. А теломеры – лишь предположительный механизм, который уже во многом пересматривается. Так как ДНК могут делиться и без теломеров и там много нюансов. И есть животные у которых нет теломеров, либо есть животные у которых теломеры никак не связаны со старением вообще. А также понятно, что не только теломераза управляет длиной теломеров. А также длина теломеров вообще – скорее совпадение. Так как просто в новых клетках новые теломеры. Новые клетки постоянно рождаются из стволовых. И лишь когда стволовые клетки с возрастом работают все хуже, то общая длина теломеров в специализированных клетках снижается – из-за того, что им на замену все позже приходят новые клетки.
К тому же Хейфлик лишь подтвердил, что давно предположил Оловников. Оловников же уже давно от своей гипотезы по теломерам отказался.
Давно еще Оловников предположил, что “счетчиком” являются теломеры – кончики хромосом, которые укорачиваются при каждом делении. А в половых и раковых клетках это укорочение предотвращает особый фермент – теломераза.
В 90-е годы XX века теломераза была найдена, укорочение теломер подтвердилось. Но оказалось, что непосредственной причиной старения оно не является. Тогда Оловников предложил новую гипотезу: о существовании принтомер – особых ДНК, в которых содержится “память” о специализации клетки. Все вместе они составляют парагеном, укорочение которого и приводит к старению. Сейчас Оловников ищет возможность подтвердить справедливость этой гипотезы в экспериментах.
rg.ru/2010/02/18/reg-ural/dolgoletie.html
Вполне возможно и принтеры будут опровергнуты. Так, что никаких фундаментальных открытий в теломерах нет. Просто промежуточная гипотеза. И ни один серьезный ученый теломеры в качестве причины старения уже не воспринимает.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Уверенность в чем?
Я не говорю о теломерах. Дались мне эти теломеры! Я предполагаю некий другой механизм, который программирует постепенное хирение линии соматических клеток. Это могут быть эпигенетические механизмы, реализация которых кодирована в геноме. Я же говорю, если этого не нашли, то не значит, что этого нет!
Уверенность в том, что стволовые клетки можно омолодить. Я же говорю, что это просто может быть морфологическое омоложение!
Зачем нужны какие-то принтомеры? Есть митоз – клетка просто копируется со всем набором эпигенетических изминений специализации. Так что идеи Т.Д. Лысенко находят подтверждения, хотя и отчасти. Можно вывести за скобки МЕХАНИЗМ запрограммированного старения, главное доказать, что такой механизм существует.
Может сам механизм хирения линии специализированных клеток как раз и заключается в накоплении не столько ошибок в ДНК, сколько в накоплении ГРУЗА эпигенетических ошибок специализированных клеток. И этот груз статистически-вероятностный – неизбежный.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Эпигегетика при ее откате мало днйствует на продолжительность жизни.
Тогда чем отличие специализированных клеток от клеток простейших, которые бессмертны? Я вижу отличие только в том, что геном простейших задействован почти полностью и видимо почти не имеет неиспользуемых смысловых последовательностей ДНК. Возможно нужно искать разгадку в этом направлении.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Копаться в геноме не имеет смысла. Там все очень сложно и много чего не известно.
Дмитрий, что такое “эпигенетический откат”? Если понимать под откатом прекращение экспрессии многих генов, которые обуславливают клеточную специализацию, то это я думаю ничего не даст. Я говорю о грузе поломок внутри цитоплазмы, дисфункции различных клеточных систем регуляции самоподдержания жизнедеятельности клетки, которые могут усугубляться в каждой последующей клеточной генерации, которые чем дальше отстоят от стволовых, тем более этому подвержены. То есть, одно дело взять нативную стволовую клетку, а другое дело взять клетку энной генерации и попытаться превратить её в стволовую… Это будет просто лажа по моему мнению. Такое происходит в организме, когда возникает рак. Такие клетки примитивизируются, но некоторые вместе с тем обладают способность к неограниченному размножению, но это не говорит о их высоких жизненных потенциях, потому что это регрессивные клетки.
Итак, у простейших не наблюдается старения в линии клеток. Отдельные особи видимо элиминируются после износа цитоплазмы, мутаций и поломок ДНК, но это не влияет на популяцию, так как к этому времени эти особи уже оставили потомство. Репаративные процессы в ДНК и в цитоплазме у простейших по всей видимости на очень ВЫСОКОМ уровне. Можно предположить, что феномен старения мог быть запрограммирован ЭВОЛЮЦИЕЙ просто путем ОСЛАБЛЕНИЯ репаративных процессов цитоплазмы и ДНК у всех клеток многоклеточного организма, начиная от стволовых. Таким образом, каждое последующее деление клетки привносит в фенотип клетки новые повреждения, которые не могут быть репарированы должным образом. В конце концов судьба этой линии, после определенного числа делений – апоптоз. Те клетки, которые по каким-то причинам не подверглись апоптозу вовремя превращаются в стареющие, то есть предраковые и в идеале удаляются иммунной системой. Возможно, укорачивание теломер это последний рубеж защиты от рака, но прежде срабатывает апоптоз, потом иммунитет. В феномене апоптоза для проджления жизни важно то, что возможно это не слишком избирательный процесс – зачастую удаляются ещё вполне жизнеспособные линии клеток, что требует замены их со стороны стволовых депо клеток. Перерасход стволовых клеток приводит к их дефициту и в конечном счете к смерти. По моему мнению, количество стволовых клеток ограничено, они также подвержены старению при каждом последующем делении.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Мне сложно комментировать, когда я слышу слово ЗАПРОГРАММИРОВАНО. С таким же успехом можно говорить все те же слова, только вместо запрограммировано поставить “создано инопланетянами” и др. Это лишь фантазии. Программирование сначало нужно доказать, а потом его уже ставить везде в гипотезы.
Я считаю, что никаких проблем не было бы для Природы создать нестареющий многоклеточный организм, как это мы видим в случае простейших – одноклеточных организмов. Но поскольку это не нужно для Природы и эволюции такого организма не существует. Понимание того, что мы боремся не с неизбежностью, что можно обмануть Природу позволило бы выбрать правильный путь к бессмертию. Если этот путь сработает, то тогда станет ясно, что гипотеза верна. Я думаю, что знаю что нужно делать 🙂
Прочитал ,что количество некоторых видов сшивок уменьшается с возрастом …ещё что синтез коллагена падает и возможно это влияет на прочность ячеек матрикса и склонность к сшивкам,так как структура становится хрупкой…Хочется побольше статей об матриксе и все что к нему относится
Дмитрий, вот график зависимости количества сшивок от возраста (учитывающий объем) static1.squarespace.com/static/5408e9b3e4b0e5142540c5d3/t/5640c31ce4b0c7ff8f6e11ef/1447084830200/?format=750w
из него видно что во время активного роста (с 8 -16 лет) и в период с 16 -26 лет ,скорость накопления сшивок примерно одинаковая, то есть сшивки не разбавляются в объеме, и дело в обмене коллагена, которая с возрастом падает, из-за замедления разрушения плохого матрикса, так как накапливаются сшивки делающие его жестче и колагеназе сложнее разрушать плохой матрикс ,и возможно сам синтез калогеназы падает, а с постройкой нового матрикса проблем скорее всего нету, организм способен его производить достаточно (взять то же детство когда его образуется огромное количество)…Сшивки накапливаются даже в детстве, но очень медленно…надо разрушать сшивки фарм препаратами или усиливая свои протеиназы (либо и то и то), которые разрушат эти сшивки быстрее их образования…в белках с быстрым обменам сшивки хоть и образуются, но они не старят, так как белок быстро меняется на новый, в коллагене обмен медленный…надо сделать его быстрее(скорее всего именно разрушение старого матрикса коллагеназой или фарм препаратами)…возможно ещё при рождении обмен коллагена быстрее накопления сшивок , или в период до 5 лет который не указан на графике…Во время голодания накопления сшивок меньше, но наверно ведь и скорость обмена коллагена падает? вот бы её ускорить в этот период…как интересно влияет температура на обмена коллагена (холодная, горячая или контрастный душ)…или может есть уже способ ускорить обмен коллагена?…
под словом усиления обмена я имею ввиду достаточный синтез нового для замены плохого старого, при том что старый удаляется с достаточной скоростью, чтобы не накапливаться…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Когда коллаген сшивается, то теряется доступ к коллагеновым волокнам. И можно удалять его только участками, убивая всю ткань.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Пока из этого ничего не следует. Пришлите источник и посмотрим.
Обратите внимание на следующее. В детстве матрикс образуется, потом, скажем в период 20-40 лет обмен коллагена тоже на достаточно больших значениях. График, представленный Ромой, static1.squarespace.com/static/5408e9b3e4b0e5142540c5d3/t/5640c31ce4b0c7ff8f6e11ef/1447084830200/?format=750w, не учитывает количество сшивок к скорости обмена коллагена. В детстве матрикс синтезируется и естественно большое количество сшивок, но и в старости большое количество образовавшихся сшивок, при том, что матрикс-коллаген почти не обновляется. Получается, что соотношение скорости образования сшивок к скорости обновления коллагена в старости очень большое. Таким образом, если мы видим на графике пологую кривую, это не должно вводить в заблуждение: да, в детстве накапливается много сшивок, но матрикс при этом заново синтезируется – это стохастический процесс, а потом сшивки, как мне кажется, образуются именно из-за возрастания дисфункциональности фибробластов, ибо потребности в синтезе большого количества матрикса нет. Возможно, постепенное снижение скорости обмена коллагена во время жизни можно рассматривать и как защита против образования новых сшивок, а это влечет за собой физико-химическое устаревание матрикса-коллагена.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
ГРафик представленный Ромой сначала Роман должен подтвердить ссылкой на исследование.
Далее я должен это исследование прочитать и посмотреть методы исследования.
И уже потом делать выводы
Интересно посмотреть график количества сшивок зависящий от возраста(особенно в период роста организма и переход к завершению и после завершения роста) учитывающий объем тела…
Инъекция стволовых клетов в мозг продливала жизнь мышам на 15 %…почему не пропробывать их делать не только в мозг….да и в старой среде они быстро теряют свои функции,надо попутно удалять старую среду…да и как часто они её делали….может только один раз
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Роман. Дайте ссылку на этот факт.
Дмитрий,а что если по мере роста стволовые клетки часто делятся и организм состоит из молодых клеток ,которые обновляют матрикс,разрушают старый и выробатывают достаточно гиалуроновой кислоты,припятствующей сшивкам,но когда рост прекращается стволовым клеткам делится не надо особо и организм начинает обновлятся в основном за счет обычных клеток которые делятся и со временем работают всё хуже и это сильно влияет на матрикс…и у каждого вида животных стволовые клетки на самом деле делятся качественно без рака определенное количество раз(так как они ведь со временем тоже накапливают ошибки и должны быть убиты генами)…
Интересно,есть ли график зависимости количества сшивок от возраста…с самого рождения до глубокой старости…найти там зависимости и сделать какие-нибудь выводы…
Гормон роста стимулирует калоген,делает матрикс жестче,сокращает жизнь …
У гидры межклеточный матрикс это мезоглей, состоящий на 98% из воды и на 2 из калогена…то бишь почти только вода в отличии от человека…гиалуронавая кислота задерживает воду в матриксе и продливает жизнь….глюкозамин задерживает воду,продливает жизнь…этр делает матрикс жиже и легче питаются клетки и уходят отходы их жизнедеятельности
Дмитрий,а старый матрикс влияет на клетки за счет того что пути по которым проходят питательные вещества и утилизируются отходы зарастают сшивками или потому что сама структура меняется и это влияет(то бишь допустим ячейка матрикса была ромбом ,а стала треугольником) ?или как-то подругому
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Влияет и тем, что нарушает питание, нарушает проводимость электрического сигнала через матрикс, а также конечно механически, изменяя форму из-за сшивания и оказывая механическое действие на рецепторы клеточных мембран
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
И действительно. Также не сам собой напрашивается вывод, что африканцы черные потому что они больше едят бананы. Логично же. А китацы узкоглазые, потому что больше едят рис. То же ведь логично.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Роль теломер тоже недоказана. А мной высказаны лишь данные исследований, которые показывают, что чем длиннее теломеры, тем быстрее старение.
Похоже, что теломеры это такой индикатор, который запрещает клетке делиться при его низких значениях, что даже хорошо, когда клетка старая и портит окружающие её, а также быстрее наступает её апоптоз. Но вот когда клетка вполне себе хорошая, а теломеры у неё низкие, то она раньше времени впадает в апоптоз и это усиливает нагрузку на стволовые клетки, которые зря трудятся выпуская замену этой ещё хорошей клетке.
В общем теломеры это часть общего механизма клеточного апоптоза, и пока нельзя его идеально отрегулировать и в нужное время применять (это наверное только нанороботы смогут), то думаю вмешательство в теломеры – ничего существенного в борьбе со старением не даст.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Да. Не даст.
А давайте заведем в discordapp.com/ группу и там будем обсуждать такие вопросы и не только. Текстовой и голосовой чат для геймеров, но можно использовать под свои нужды. Бесплатен, хорошо настраивается, можно создавать много тем, настраивать доступ. Полезен для создания комьюнити, его развития и самоподдержки. Просто в 2018 что-то в фейсбуке обсуждать)))))
Кстати, про Цацулина. У него полудохлый канал, но все равно прилично просмотров (100к+ просмотров при 500к подписчиков). Да, он клеит калажики и давит на эмоции, как и все на ютубчике и аудитория соответствующая. По сути, он пиарит нестарение и это хорошо, плюс можно подняться на анализе его роликов, а это на ютубе работает ох как хорошо, а косяки у него в видео имеются.
И, вообще, это полезно и оголяет слабые места проекта, что очень полезно. Ни в коем случае не закрываться и не прятаться, а использовать в своих целях.
Выходит 3 варианта…1.организм видит что он ещё должен рости и не сбавляет синтез стволовых клеток,клеток влияющих на матрикс и тд. 2.в организме есть мерило объем к сшивкам,которое дает сигнал…3.новый объём в виде новых клеток и матрикса обновляют весь организм ,так как всё едино
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
2. В организме не мерило, а матрикс механически влияет на рецепторы клеток. И меняет их здоровье. Чем более жесткий матрикс, тем хуже это влияние.
Остальные слова я не понял
А почему вообще коллаген сшивается? Реакция с кислородом? Вы вроде писали что он даже сам по себе сшивается.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Ферментативная реакция. В статье про матрикс есть про это и есть ссылки где почитать.
Что именно программирует матрикс, чтоб он имел определенное строение? нет ли там своих теломер?почему у гидры например, ведь тоже есть старый матрикс и когда она достигает определенного возраста и делится ,ведь часть сшивок остается в ней (допустим половина) и ведь объем меньше её становится (допустим тоже половина )выходит сшивки не разбавляются…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Гидра все время растет
Получается новый достроевшийся объем влияет на старые клетки…то есть ,либо он просто омолаживает весь организм так как сам молодой,либо в организме есть своебразное мерило количество сшивок к объему и которое даёт сигнал всему организму
Интересно, почему при использовании теломеразы в пробирке на клетках удалось сделать их бессмертными, ведь матрикс старел…или им его обновляли?или там клетки были которые делали хороший матрикс?или они вообще не в матриксе были?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Сначала нужно понять, что кроется за словами бессмертными. Тогда секрет фокуса станет понятным
Думаю, пока на нынешнем этапе нужно тщательно и скрупулёзно смотреть физиологию голого землекопа в плане долголетия и по возможности внедрять в человеческую, чтобы не было ощутимого падения качества жизни.
Относительно низкие гормоны, относительно низкая температура тела, регулярная умеренная физкультура для предотвращения саркопении и остеопороза и главное – найти возможность накапливать в матриксе значительное количество гиалуроновой кислоты, как это делает голый землекоп. И тогда может удастся поднять среднюю продолжительность жизни в два раза, до 150 лет. А там уже в дальнейшем – нанороботы, убирающие сшивки.
Надо искать что хорошо влияет на матрикс…какие гены,гормоны(эстрагены и тд),свободные радикалы ,фарм препараты,пептиды,образ жизни,клетки которые могут влиять на него,температура и тд
Антиоксиданты…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Все, что продлевало максимальную продолжительность жизни долгоживущим мышам, кроме толомеров, все это замедляло старение матрикса.
Матрикс голого землекопа обновляется лучше чем у мышей ,хоть они не ростут всю жизни ,может дело в характеристиках их клеток, обновляющий матрикс
Либо накапливает меньше в разы количество сшивок по мере жизни…возможно из-за особенностей фибробластов
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Дело в их низком метаболизме, а также в гиалуроновой кислоте
Или допустим делать частые инъекции стволовых клеток которые могут превратиться в любую с попутным удаление старых клеток…чтобы скорость поступления нового материала превышала скорость старения старого …и ещё как я понял нам нужно именно увеличить количество хорошего матрикса и желательно убрать плохой…Надо получается найти способы делать матрикс лучше
Надо проверить что будет со старым матриксом если добовлять новые клетки которые могут его улучшить и чтоб скорость починки была быстрее состаривания клеток из-за старого матрикса
Допустим взять характеристики клеток улучшающих матрикс у китов или слонов и внедрить в наши…скорость улучшения матрикса должна быть коллосальной
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Киты и слоны дольше нас растут
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Новые клетки не могут разбивать сшивки между коллагеном. А попытка ускорить обновление матрикса – это фиброз
Как я понял, то старые клетки и старый матрикс падают сигнал стволовым чтоб они были менее активными и они медленее обновляют организм,а что если сигнал как -то прервать и удалить старые клетки…старых клеток не будет,стволовые клетки сделают им замену,а матрикс должен стать лучше за счет новых фибробластов и клеток чистильщиков…попутна изменить гены которые помогут клетками чинить днк либо уничтожаться если это необходимо…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
ТАк уже делали на мышах. В итоге прогерейные мыши прожили всего на 40% дольше. Нужно матрикс омолаживать
Добрый день, спасибо за статью. Есть над чем подумать! Хотела бы попросить выслать мне книжечку вашу, анкету заполнила, очень хочется прочесть скорее книгу! Благодарю!
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
ок
Надо значит делать акцент на новые стволовые клетки,а не продливать жизнь старым за счет теломеразы…И хотелось бы узнать в чем именно отличие старых клеток от молодых…количество мутаций,длина теломер или что другое
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Отличие в специализации