Дата создания: 6 ноября 2022
Обновлено: 29 декабря 2023
Радикальное продление жизни — часть 7. Методы, продлевавшие жизнь мышам, бесполезны для человека
Как мы представляем себе нашу жизнь, а точнее какой мы хотим ее видеть?

Рисунок 1.
- Рождение
- Счастливое наивное детство
- Мама и папа
- Книга жизни листает страницу за страницей
- Любимый и единственный человек
- Счастливый смех своих детей
- Солнечная мечта
- Жизнь никогда не закончится
- Жить удивительно хорошо
- Таинственно
- Нет большей ценности чем жизнь
- Хотим знать каким будет будущее
- Ведь однажды будущее настанет
- Все хочется увидеть
Однако, мы умеем мечтать. Но жизнь совсем не такая. Болезнь близких и утрата. Беспомощность, дряхлость и одиночество. Больше ничего нет. Темно, ничего, пустота. Так заканчивается наша жизнь. О чем мы поговорим в данной статье?
Прорыв в различных научных сферах, в том числе и в биологии, происходит после смены поколений, когда более старое поколение своей уверенностью в невозможности чего-либо, больше не тормозит научный прогресс. Математически старение — это процесс, приводящий к росту вероятности заболеть в каждый момент времени с возрастом, а позже к росту вероятности умереть в каждый момент времени с возрастом. То есть старение - это ускорение смертности, а не внешние изменения. Сегодня ни одной исследовательской группе, ни разу не удавалось воспроизводимо замедлить скорость старения нормальных, а не коротко живущих мышей. Мало вероятно, что комбинации методов, увеличивавших продолжительность жизни в экспериментах на мышах, смогут увеличить максимальную продолжительность жизни (МПЖ) человека, так как большинство этих комбинаций уже работают при сокращении калорийности рациона у мышей. А людям сокращение калорийности рациона дает эффект, аналогичный отсутствию ожирения, что не влияет на МПЖ человека, а лишь может улучшить здоровье. Пора переходить от исследований биологии старения мышей к исследованиям биологии старения человека. Люди потому и живут долго, что большинство известных проблем, ограничивающих жизнь коротко живущих животных, биология человека уже решила. Долгоживущие животные, проживающие в оптимальных условиях, вероятно, уже исчерпали ресурс продления жизни за счет снижения базовой уязвимости. Это относится и к человеку, который живет в условиях хорошей гигиены, безопасности и имеет медицинское обслуживание. Если ученый будет упираться в публикацию научной статьи с новой прорывной теорией, ему придется работать над одной статьей многие годы. Это не способствует росту его карьеры. В результате огромное количество статей приводит не к смене центральных идей в науке, а скорее к окостенению канона и отсутствию научного прогресса. На физическом уровне старение - это постепенное нарастание жесткости, потеря эластичности тканей, окружающих клетки организма. Когда мы понимаем, в каком возрасте находится предел продолжительности жизни человека, то это позволяет точнее понять, что именно людям не позволяет жить дольше. Приблизительный верхний предел продолжительности жизни человека ограничивается на отметке 100-120 лет эластичными свойствами сердца, артерий, и системы дыхания. Чтобы восстановить уровень эластичности артерий, нужно разрабатывать технологии, нацеленные на восстановление скорости синтеза нового эластина и очищения его от кальция. Введение интерлейкина 7-го типа и фактора роста кератиноцитов, трансплантация эпителиальных клеток тимуса, использование внеклеточной матрицы в качестве каркаса для клеток с целью регенерации тимуса, излечение аутоиммунных заболеваний с помощью анти-CD19 CAR-T-клеточной терапии, а также пересадка костного мозга - перспективные методы омоложения иммунной системы. Потенциальные средства, которые имеют шансы на омоложение, либо замедление прогрессирования заболевания почек в будущем: эверолимус, ингибиторы натрий-глюкозного транспортера 2-го типа, трансплантация поджелудочной железы, подавление фактора ингибирования миграции макрофагов, ингибирование активатора плазминогена 1-го типа, пирфенидон. Перспективными методами омоложения мозга являются восстановление функции микроглии и технология снижения жесткости внеклеточного матрикса головного мозга.
И еще. Если вы увидите подобные идеи на русском языке на других сайтах, то помните, что на этом блоге эта информация появилась раньше. Остальные копируют.
Прорыв в различных научных сферах, в том числе и в биологии, происходит после смены поколений, когда более старое поколение своей уверенностью в невозможности чего-либо, больше не тормозит научный прогресс
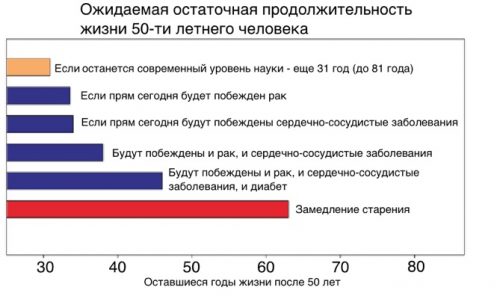 Рисунок 2. Ожидаемая остаточная продолжительность жизни в развитых странах после того, как человеку исполнилось 50 лет [pubmed.ncbi.nlm.nih.gov/12610292].
Рисунок 2. Ожидаемая остаточная продолжительность жизни в развитых странах после того, как человеку исполнилось 50 лет [pubmed.ncbi.nlm.nih.gov/12610292].
Рисунок 2 демонстрирует, что если человеку уже исполнилось 50 лет, то можно ожидать, что он еще проживет в среднем 31 год (до 81-летнего возраста). Рак, сердечно-сосудистые заболевания (ССЗ), сахарный диабет 2-го типа - это чаще всего возрастные заболевания, которые сокращают нашу продолжительность жизни. Если бы медицина победила рак, то ожидаемая продолжительность жизни (ОПЖ) после 50-ти лет составила бы около 33 лет. Если бы победили все ССЗ, то ОПЖ после 50-ти лет составила бы около 34 лет. Если бы победили и рак, и ССЗ, то ОПЖ после 50-ти лет составила бы около 38 лет. А если бы победили и рак, и ССЗ, и сахарный диабет, то ОПЖ после 50-ти лет составила бы около 46 лет. То есть люди бы доживали в среднем до 96-летнего возраста (50 + 46 = 96). Такой прирост продолжительности жизни не очень большой, если сравнивать с тем, сколько бы мы жили, если бы после 50 лет остановилось старение. Если бы люди в 50 лет перестали стареть, оставались бы 50-ти летними навсегда, то ОПЖ после 50-ти лет составила бы около 63 лет. Люди бы доживали до 113 лет в среднем (50 + 63 = 113). А те, кому повезет, доживали бы и до примерно 140-летнего возраста.
А если бы люди в 50 лет не оставались всегда 50-ти летними, а омолодились бы до юного возраста, то ОПЖ могла бы достигать уже 1000 лет. Но об этом мы поговорим немного позже.
А теперь вопрос. Кто из вас не верит в то, что будет жить больше 100 лет? А кто верит? Кто верит - правильно делает. Почему? Вот почему.
 Рисунок 3. Джордж Бернард Да́нциг (1914 – 2005) на вручении Национальной научной медали, 1976 год.
Рисунок 3. Джордж Бернард Да́нциг (1914 – 2005) на вручении Национальной научной медали, 1976 год.
Джордж Бернард Да́нциг вырос в семье математиков. Он учился на математика и часто опаздывал на занятия. Однажды, как рассказывал сам Да́нциг, он опоздал на занятия на 20 минут. На доске были написаны задачки. Бернард Да́нциг подумал, что это домашнее задание. Спрашивать профессора постеснялся. Итак, опоздал на занятие. Дома никак не мог решить эти задачки. Но через 3 дня ему удалось их решить. Задание сдал. В течение месяца судьба домашнего задания оставалась неизвестной, пока нерадивого студента не вызвали в деканат. Бернард Да́нциг решил, что его хотят отчислить. Но вместо отчисления его просто спросили о том, сам ли он решил эти задачи. Оказалось, что это были нерешённые проблемы статистики, с которыми даже самые маститые учёные того времени не могли справиться в течение многих лет. Если бы Бернард Да́нциг знал, что эти задачи невозможно решить, то он никогда бы этого не сделал, как он сам признавался. Теперь Да́нциг считается основоположником линейного программирования и является одним из величайших математиков [projecteuclid.org/journals/annals-of-mathematical-statistics/volume-11/issue-2/On-the-Non-Existence-of-Tests-of-Students-Hypothesis-Having/10.1214/aoms/1177731912.full].
И вот вам сегодня многие известные профессора говорят, что старение нельзя победить. Это самое плохое, что они могут для Вас сделать. Так как после таких слов, Вы даже не попытаетесь это сделать. Кстати, исследования показывают, что прорыв в различных научных сферах происходит после смены поколений, когда более старое поколение своей уверенностью в невозможности чего-либо, больше не тормозит научный прогресс.
О чем мы поговорим в этой статье? Сегодня ожидаемая продолжительность жизни (ОПЖ) уперлась в барьер 85 лет, а максимальная продолжительность жизни (МПЖ) уперлась в 115 лет. Но уже скоро очень вероятен прорыв в медицине. ОПЖ может стать 95 лет, а МПЖ - 125 лет. Уже известны технологии, которые потенциально позволят людям в конце 21 века достичь МПЖ, вероятно, за пределами 200 лет. Итак, читайте дальше. Я постараюсь, чтобы после прочтения этого материала Вы поверили в это.
Математически старение — это процесс, приводящий к росту вероятности заболеть в каждый момент времени с возрастом, а позже к росту вероятности умереть в каждый момент времени с возрастом. То есть старение - это ускорение смертности, а не внешние изменения
 В 2016 году, ученые из университета Нидерландов создали новый пептид. В результате они активизировали фактор транскрипции FOXO-4 (факторы транскрипции - это белки, которые "умеют" читать информацию с определенных участков генетического кода, записанного в ДНК).
В 2016 году, ученые из университета Нидерландов создали новый пептид. В результате они активизировали фактор транскрипции FOXO-4 (факторы транскрипции - это белки, которые "умеют" читать информацию с определенных участков генетического кода, записанного в ДНК).
Созданный пептид делал мышей с ускоренным старением более молодыми внешне.
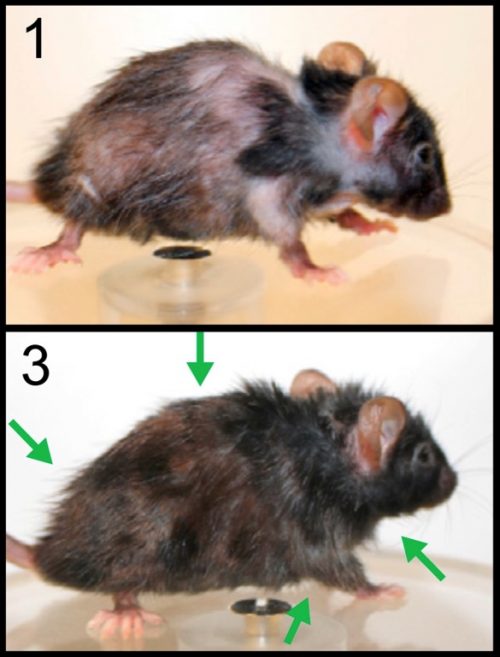
На рисунке 4 одна и та же мышь до и после терапии с помощью FOXO4-DRI [pubmed.ncbi.nlm.nih.gov/28340339].
Кажется, что мышь, показанная на рисунке 4, омолодилась. Но могут ли внешние изменения, либо улучшение каких-то показателей здоровья, гарантировать, что было омоложение, либо остановку или замедление старения? И будет ли такая мышь жить дольше?
Как Вы считаете? Давайте разбираться.
 В следующем исследовании лечение альфа-липоевой кислотой, хотя и улучшало память, снижало количество ошибок в когнитивных процессах, снижало уровень окислительного стресса, но сокращало продолжительность жизни мышей. Как же так? Ведь мыши демонстрировали функции более молодых животных.
В следующем исследовании лечение альфа-липоевой кислотой, хотя и улучшало память, снижало количество ошибок в когнитивных процессах, снижало уровень окислительного стресса, но сокращало продолжительность жизни мышей. Как же так? Ведь мыши демонстрировали функции более молодых животных.
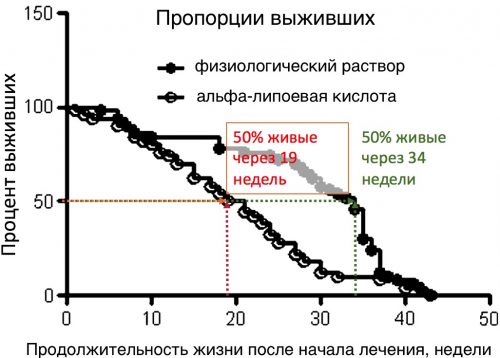
Рисунок 5. Мыши, получавшие альфа-липоевую кислоту, имели медиану выживаемости 20 недель после начала лечения по сравнению с мышами, не получавшими лечение, у которых медиана выживаемости составляла 34 недели [ncbi.nlm.nih.gov/pubmed/22785389].
Итак, нужно ли нам омоложение, которое сокращает жизнь? И вообще, чем прежде всего опасно старение? Морщинами? Седыми волосами? Согласитесь вы или нет, но мое мнение, что основная проблема старения заключается в том, что оно приводит к неминуемой смерти. И именно этим оно и страшно. Многие из нас готовы жить с морщинами и седыми волосами, если при этом продолжают жить.
 Рисунок 6. Лорд Келвин - ученый, который применял законы физики к любым научным и техническим проблемам.
Рисунок 6. Лорд Келвин - ученый, который применял законы физики к любым научным и техническим проблемам.
"Если вы не умеете это измерять, то вы не знаете, о чем вы говорите", писал Лорд Келвин.
Чтобы понимать, что мы говорим о старении, то давайте научимся его измерять. А точнее научимся измерять скорость старения.
И чем быстрее эта скорость, тем быстрее старение нас убивает.
 Математически старение — это процесс, приводящий к росту вероятности заболеть в каждый момент времени с возрастом, а позже к росту вероятности умереть в каждый момент времени с возрастом. То есть старение - это ускорение смертности.
Математически старение — это процесс, приводящий к росту вероятности заболеть в каждый момент времени с возрастом, а позже к росту вероятности умереть в каждый момент времени с возрастом. То есть старение - это ускорение смертности.
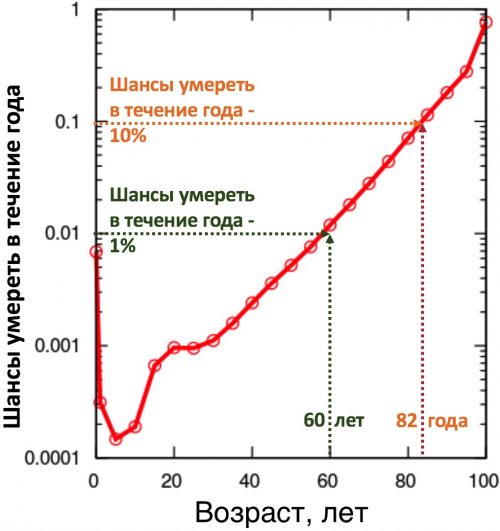
На рисунке 7 - кривая Гомпертца-Мейкхама. Оценочная вероятность смерти человека в каждом возрасте для США в 2003 году. Уровень смертности растет с возрастом после 30 лет. Так в 82 года риск умереть в течение года выше, чем в 60 лет - 10% против 1% [cdc.gov/nchs/data/nvsr/nvsr54/nvsr54_14.pdf].
Вот такое увеличение риска умереть в течение года с каждым годом и является скоростью старения.
 Еще важно понимать, что победа над старением хоть и увеличивает продолжительность жизни, но не делает организм бессмертным. Так как не только старение сокращает продолжительность жизни. Если не только старение, то что еще?
Еще важно понимать, что победа над старением хоть и увеличивает продолжительность жизни, но не делает организм бессмертным. Так как не только старение сокращает продолжительность жизни. Если не только старение, то что еще?
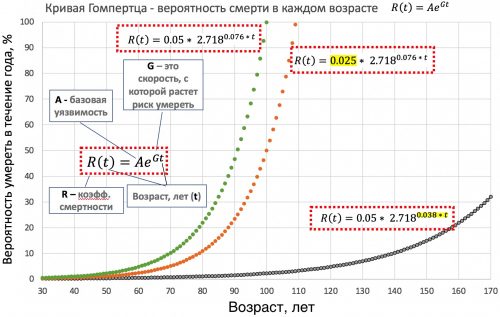
Рисунок 8. Кривая Гомпертца (зеленый цвет) отражает вероятность умереть в течение года в каждом возрасте. Формула, которая описывает закон Гомпертца, содержит две важные переменные: А - базовая уязвимость, а также G - скорость старения. Примечание: значение переменных для кривой могут не соответствовать фактическим, а взяты для примерной демонстрации формулы. Если базовую уязвимость (А) сократить в два раза (с 0.05 до 0.025), то кривая смертности Гомпертца сдвинется параллельно вправо (оранжевый цвет), что соответствует увеличению продолжительности жизни примерно на 10 лет. Если же скорость старения (G) сократить в два раза (с 0.076 до 0.038), то кривая смертности Гомпертца резко изменит свой наклон (серый цвет), что позволит увеличить максимальную продолжительность жизни в разы. Как видно из графиков, снижение скорости старения (G) даст на порядок больший прирост продолжительности жизни, чем снижение базовой уязвимости (A).
Сегодня ни одной исследовательской группе, ни разу не удавалось воспроизводимо замедлить скорость старения нормальных, а не коротко живущих мышей. Об этом мы поговорим чуть позже. Все рекорды увеличения продолжительности жизни мышей были достигнуты только за счет снижения базовой уязвимости. А что такое базовая уязвимость? Это то, что делает организм уязвимым к плохим условиям жизни.
- Испанский грипп в 1918 году забрал от 40 до 100 миллионов жизней.
- Жизнь на войне под стрессом может вызывать атеросклероз и рак.
- Жизнь в условиях дефицита питания, может привести к смерти из-за истощения.
- Лежание целыми днями на диване и обжорство приводят к ожирению, и повышают риски заболеть и умереть.
Все это примеры базовой уязвимости. Так сокращение калорийности питания не замедляло старение (рассмотрим позже), но увеличивало продолжительность жизнь мышей, которые жили в клетке, защищая их от ожирения - снижало базовую уязвимость (А) [ncbi.nlm.nih.gov/pubmed/7501958]. Сокращение калорийности питания продлевало жизнь приматам лемурам, которые жили в клетках [nature.com/articles/s42003-018-0024-8]. Малоподвижный образ жизни повышает риск ожирения и смерти у людей. Таким людям нужно меньше есть [pubmed.ncbi.nlm.nih.gov/30817262]. Но если бы мыши или приматы жили не в клетке, а в поле, то сокращение калорийности питания могло бы оказаться бесполезным для продления жизни. Так сокращение калорийности питания не продлевало максимальную продолжительность жизни макакам резусам, которые жили в Национальном парке [pubmed.ncbi.nlm.nih.gov/28094793].
Многие из вас слышали об экспериментах, в которых мышам увеличивали продолжительность жизни за счет удлинения теломер [pubmed.ncbi.nlm.nih.gov/22585399], снижая базовую уязвимость (А), что покажем позже. Теломеры тоже сокращались быстрее из-за малоактивной жизни мышей в клетках, переедания и ожирения. А достаточная физическая активность [pubmed.ncbi.nlm.nih.gov/21102320] и оптимизация калорийности рациона питания [pubmed.ncbi.nlm.nih.gov/26826704] защищают от преждевременного сокращения теломер.
Удаление старых клеток продлевало жизнь мышам, влияя на базовую уязвимость (покажем позже), которые накапливали не оптимальное количество старых клеток из-за сидения в клетках [nature.com/articles/nature16932], а не жили в естественных условиях. А физические упражнения и снижение потребления калорий предотвращают преждевременное накопление старых клеток [ncbi.nlm.nih.gov/pubmed/26983960] [ncbi.nlm.nih.gov/pubmed/27518560].
Но вернемся к скорости старения. Как можно объяснить, что такое скорость старения еще проще. Скорость старения - это время удвоения вероятности смерти в каждый момент времени. Так у овцы риск умереть в течение следующего года удваивается каждые 1,5 года, у мышей - каждые 3,5 месяца, а у людей – каждые 8 лет. Вот это и есть скорость старения. Как видим из данных примеров, люди стареют медленнее, чем другие рассмотренные животные.
 Может кому-нибудь будет интересно, что вопреки мнениям, древние люди, жившие 10 тысяч лет назад, старели примерно также. По данным исследований их время удвоения риска умереть в течение следующего года составляло около 9 лет.
Может кому-нибудь будет интересно, что вопреки мнениям, древние люди, жившие 10 тысяч лет назад, старели примерно также. По данным исследований их время удвоения риска умереть в течение следующего года составляло около 9 лет.
Вы, вероятно, слышали о животных, которые не стареют. Еще их называют пренебрежимо мало стареющими.
Рисунок 9. Голый землекоп.
Например, голый землекоп - млекопитающее размером с крысу, которое может жить не менее 30 лет.
Вполне возможно, что это животное живет примерно также долго, как человек или даже дольше. Но никто не наблюдал их продолжительность жизни слишком долго.
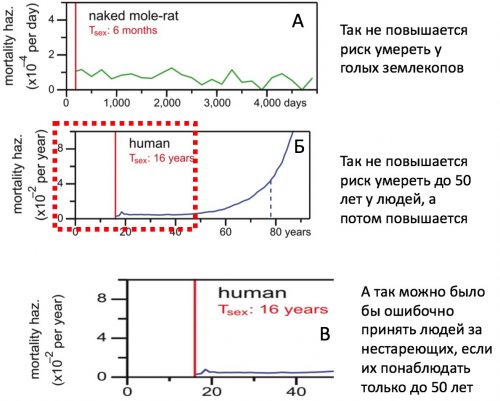 Рисунок 10. Диаграмма (А) показывает отсутствие у голых землекопов наблюдаемого роста риска умереть в каждый момент с возрастом. Однако нельзя на основании этих данных делать вывод о том, что голые землекопы не стареют. Невозможно делать выводы о старении этих животных, пока они все не умерли в наблюдаемой совокупности. А ведь на момент публикации исследования, еще больше половины наблюдаемой выборки этих животных были живы. Ведь если понаблюдать кривую смертности человека на диаграмме (Б), то видно, что до 40 лет риск умереть в каждый момент времени у людей тоже не растет. И если наблюдать людей только до 40-летнего возраста, как на диаграмме (В), то также можно ошибочно считать людей нестареющими. Поэтому стареет ли голый землекоп или нет - станет известно только спустя десятки лет наблюдения.
Рисунок 10. Диаграмма (А) показывает отсутствие у голых землекопов наблюдаемого роста риска умереть в каждый момент с возрастом. Однако нельзя на основании этих данных делать вывод о том, что голые землекопы не стареют. Невозможно делать выводы о старении этих животных, пока они все не умерли в наблюдаемой совокупности. А ведь на момент публикации исследования, еще больше половины наблюдаемой выборки этих животных были живы. Ведь если понаблюдать кривую смертности человека на диаграмме (Б), то видно, что до 40 лет риск умереть в каждый момент времени у людей тоже не растет. И если наблюдать людей только до 40-летнего возраста, как на диаграмме (В), то также можно ошибочно считать людей нестареющими. Поэтому стареет ли голый землекоп или нет - станет известно только спустя десятки лет наблюдения.
Сегодня ни одной исследовательской группе, ни разу не удавалось воспроизводимо замедлить скорость старения нормальных, а не коротко живущих мышей
В заголовке статьи звучит вопрос. Удавалось ли ученым замедлить скорость старения млекопитающих животных? Сразу отвечу. Нет. Не удавалось воспроизводимо (!) замедлить скорость старения млекопитающих. И ниже предлагаю обсудить это утверждение.
Выше мы выяснили, что формула закона смертности Гомпертца, которая отражает вероятность умереть в течение года в каждом возрасте, содержит две важные переменные: А - базовая уязвимость, а также G - скорость старения. Рассмотрев все эксперименты, в которых мышам изменяли работу генов с помощью генной инженерии, либо с помощью изменения эпигенетики, ученые из канадского университета Макгила сделали вывод. Оказалось, что ни один известный ген, работа которого продлевала жизнь мышам, не влиял на скорость старения (G). Вместо этого было лишь влияние на базовую уязвимость (A). За счет влияния на базовую уязвимость и было достигнуто продление жизни [genetics.org/content/204/3/905]. Поэтому и результаты для мышей такие скромные. Так как без влияния на скорость старения, больших результатов получить сложно. Ведь даже при уменьшение базовой уязвимости в 100 раз ожидаемая продолжительность жизни увеличится меньше, чем при уменьшении скорости старения всего в 2 раза. Чтобы это подтвердить, достаточно воспользоваться формулой закона смертности Гомпертца и посчитать.
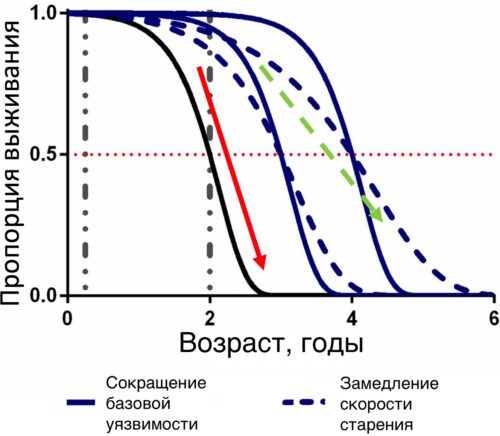 Рисунок 11. Иллюстрация изменения кривых выживания во всех известных эксперимента, в которых изменяли работу генов с помощью генной инженерии, либо с помощью изменения эпигенетики. В таких экспериментах наблюдался лишь параллельный сдвиг кривой выживания вправо, без изменения угла наклона кривой (сплошная линия и сплошная красная линия со стрелкой), что говорит о влиянии лишь на базовую уязвимость (A). В то время, как изменение скорости старения (G) привело бы не к параллельному сдвигу кривой выживания вправо, а к изменению наклона кривой выживания (пунктирная линия и зеленая пунктирная линия со стрелкой) так, чтобы ее угол наклона стал менее крутым по отношению к оси времени (возраст, годы) [genetics.org/content/204/3/905].
Рисунок 11. Иллюстрация изменения кривых выживания во всех известных эксперимента, в которых изменяли работу генов с помощью генной инженерии, либо с помощью изменения эпигенетики. В таких экспериментах наблюдался лишь параллельный сдвиг кривой выживания вправо, без изменения угла наклона кривой (сплошная линия и сплошная красная линия со стрелкой), что говорит о влиянии лишь на базовую уязвимость (A). В то время, как изменение скорости старения (G) привело бы не к параллельному сдвигу кривой выживания вправо, а к изменению наклона кривой выживания (пунктирная линия и зеленая пунктирная линия со стрелкой) так, чтобы ее угол наклона стал менее крутым по отношению к оси времени (возраст, годы) [genetics.org/content/204/3/905].
Что скорость старения в принципе возможно замедлить, нам подсказывают эксперименты на червях и мухах. Но они имеют иную биологию. А то, что ускоряло старение червям, которые живут всего 4 недели, у млекопитающих животных уже эволюция устранила. Например, в 2007 году октябрьский номер журнала Aging cell взволновал умы всех биологов мира.
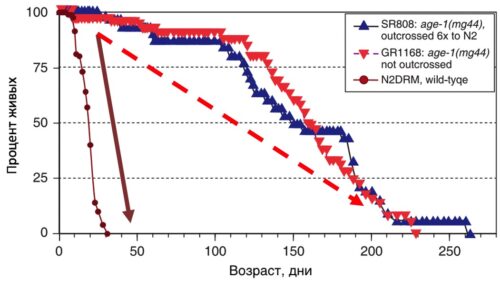 Группе ученых из Арканзасского медицинского университета (Литтл-Рок, США) под руководством Роберта Шмуклера Райса за счет всего одного изменения в гене age-1 удалось увеличить продолжительность жизни нематод в 9 раз.
Группе ученых из Арканзасского медицинского университета (Литтл-Рок, США) под руководством Роберта Шмуклера Райса за счет всего одного изменения в гене age-1 удалось увеличить продолжительность жизни нематод в 9 раз.
Рисунок 12. Кривые выживания червей нематод (коричневая линия), и червей нематод с изменением в гене age-1 (синяя и красная линии) [onlinelibrary.wiley.com/doi/full/10.1111/j.1474-9726.2007.00348.x]. Синяя и красные линии демонстрируют сильное изменение угла наклона, который стал менее крутым по отношению к оси времени (возраст, дни) [genetics.org/content/204/3/905].
Однако в биологии 9-кратное увеличение продолжительности жизни короткоживущих животных не эквивалентно 9-кратному увеличению продолжительности жизни хотя бы долгоживущих мышей. Так аналогичное вмешательство, влияющее также на ИФР-1-сигналинг мышей, увеличивало максимальную продолжительность жизни животных линии B6C3F1 всего лишь на 20% без изменения скорости старения (G), а всего лишь за счет влияния на базовую уязвимость (A) [ncbi.nlm.nih.gov/pubmed/7501958].
Часто у читателя возникает вопрос: "Почему рост риска умереть в конкретный момент времени начинает расти не с самого рождения, а лишь с какого-то возраста". Также возникает вопрос: "Как именно снижение базовой уязвимости продлевает жизнь". Чтобы ответить на эти вопросы, предлагаю рассмотреть следующий рисунок.
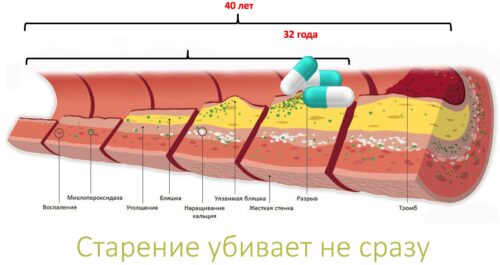 Рисунок 13. По мере старения сосуда, сначала возникает воспаление его стенок, затем развивается постепенное утолщение, и лишь через годы жизни формируется холестериновая бляшка, которая может разорваться, создавая тромб, угрожающий жизни. Через 32 года с начала развития такого процесса, наступает критическая точка, когда в результате старения начинает расти риск умереть с возрастом в каждый момент времени. Чтобы снизить базовую уязвимость (А) к разрыву тромба, пациент начинает пить статины (статины – это ингибиторы 3-гидрокси-3-метилглутарил-СоА-редуктазы (ГМКР). ГМКР – фермент, влияющий на скорость синтеза холестерина). Лечение статинами стабилизирует бляшку, снижая риск ее разрыва. В итоге базовая уязвимость (А) снижается, происходит отсрочка роста риска умереть с возрастом в каждый момент времени (с 32-х до 40 лет с начала развития процесса).
Рисунок 13. По мере старения сосуда, сначала возникает воспаление его стенок, затем развивается постепенное утолщение, и лишь через годы жизни формируется холестериновая бляшка, которая может разорваться, создавая тромб, угрожающий жизни. Через 32 года с начала развития такого процесса, наступает критическая точка, когда в результате старения начинает расти риск умереть с возрастом в каждый момент времени. Чтобы снизить базовую уязвимость (А) к разрыву тромба, пациент начинает пить статины (статины – это ингибиторы 3-гидрокси-3-метилглутарил-СоА-редуктазы (ГМКР). ГМКР – фермент, влияющий на скорость синтеза холестерина). Лечение статинами стабилизирует бляшку, снижая риск ее разрыва. В итоге базовая уязвимость (А) снижается, происходит отсрочка роста риска умереть с возрастом в каждый момент времени (с 32-х до 40 лет с начала развития процесса).
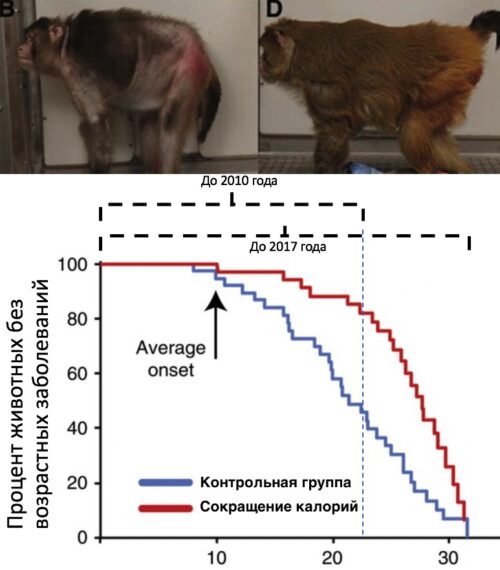 Рисунок 14. Слева пример макаки резуса, которую не ограничивали в количестве калорийности рациона. Справа пример макаки резуса, которой многие годы сокращали потребление калорий на 30%. На графике демонстрируются кривые снижения с возрастом процента животных без возрастных заболеваний [pubmed.ncbi.nlm.nih.gov/28094793]
Рисунок 14. Слева пример макаки резуса, которую не ограничивали в количестве калорийности рациона. Справа пример макаки резуса, которой многие годы сокращали потребление калорий на 30%. На графике демонстрируются кривые снижения с возрастом процента животных без возрастных заболеваний [pubmed.ncbi.nlm.nih.gov/28094793]
Как же так случилось, что макаки резусы, которые в течение жизни съедали на 30% меньше калорий, внешне выглядели более молодыми? Может быть они медленнее старели? Ученые поспешно делали такие выводы, когда наблюдали животных до 2010 года. Также, как преждевременно делали выводы о нестарении голых землекопов, которых мы рассмотрели выше. Однако, когда макаки резусы прожили еще 7 лет (до 2017 года), то стало понятно, что задержка возраста начала заболеваний у макак была обусловлена лишь снижением базовой уязвимости (A), а не снижением скорости старения (G). Так как кривая роста риска заболеть (красная линия на рисунке 14) не уменьшила свой угол наклона относительно оси времени (годы жизни) в сравнении с кривой синего цвета.
Теперь мы можем визуально посмотреть на графики, иллюстрирующие разные эксперименты, и сделать свои собственные выводы, было ли влияние на скорость старения, либо это было лишь снижение базовой уязвимости. При этом важно, чтобы в конце эксперимента умерла вся наблюдаемая выборка животных. Также важно, чтобы количество животных в экспериментах было большим. Давайте это сделаем. Для начала оценим многие известные признаки старения [ncbi.nlm.nih.gov/pubmed/23746838]. В отличии от причин старения, признаки старения ошибочно даже многие ученые путают с причинами старения. В отличии от причин старения, удаление признаков старения не замедляет скорость старения организма. К признакам, но не к причинам старения, относятся сокращение теломер, чрезмерное (!) накопление старых клеток, изменение эпигенетики, накопление ошибок ДНК, ухудшение функции митохондрий, воспаление, истощение запаса стволовых клеток и др. [ncbi.nlm.nih.gov/pubmed/23746838]. Все перечисленное не влияет на скорость старения, а только является его следствием, поэтому и называется признаками старения. Попытка устранить признаки старения напоминает желание смахнуть с себя воду во время дождя. Как не смахивай, а одежда все равно будет мокрой.
- Так Ген mclk1 кодирует фермент, необходимый для биосинтеза убихинона, важного фактора митохондриального дыхания. Частичный нокаут mclk1 +/- у мышей продлевал жизнь [pubmed.ncbi.nlm.nih.gov/16195414]. То есть, фактически прямое нарушение функции митохондрий удлиняло жизнь у червей C.elegans, мушек дрозофил и даже у мышей [pubmed.ncbi.nlm.nih.gov/29939249]. Уже известный нам голый землекоп имеет более высокие уровни окислительного повреждения в тканях по сравнению с мышами [pubmed.ncbi.nlm.nih.gov/17054663]. Таким образом, лучшая функция митохондрий не может замедлять старение, если даже ухудшении функции митохондрий продлевает жизнь.
- Удаление стареющих p16Ink4a + клеток также не замедлило скорость старения. Продление жизни было достигнуто снижением базовой уязвимости, так как наклон кривой выживания после удаления стареющих клеток не стал менее крутым по отношению к оси времени [nature.com/articles/nature16932].
- Удлинение теломер с помощью генной инженерии не замедлило скорость старения. Продление жизни было достигнуто снижением базовой уязвимости, так как наклон кривой выживания после удлинения теломер не стал менее крутым по отношению к оси времени [pubmed.ncbi.nlm.nih.gov/22585399].
- Могут ли гены, экспрессия которых увеличивает продолжительность жизни мышей, называться «генами старения» при условии, что продление жизни было достигнуто снижением базовой уязвимости? Во всех исследованиях, сообщающих об увеличении продолжительности жизни нормальных или долгоживущих мышей в результате генетических манипуляций, уменьшена базовая уязвимость (А), но не изменена скорость старения (G). Поэтому, когда мы говорим об этих генах, то не можем их называть «генами старения», но только «генами уязвимости или здоровья» [genetics.org/content/204/3/905].
- Даже нокаут гена, приводящий к дефициту гормона роста, который поставил рекорд продления жизни мышей с помощью генной инженерии, не повлиял на скорость старения животных. Продление жизни было достигнуто снижением базовой уязвимости, так как наклон кривой выживания у мышей с нокаутом этого гена, не стал менее крутым по отношению к оси времени [pubmed.ncbi.nlm.nih.gov/15536017].
- Эпигенетическое будто "омоложение" прогерийных мышей не приводило к замедлению скорости старения животных. Продление жизни было достигнуто снижением базовой уязвимости, так как наклон кривой выживания (синяя по сравнению с красной) у мышей, которых будто "омолаживали" факторами Яманаки, не стал менее крутым по отношению к оси времени [pubmed.ncbi.nlm.nih.gov/27984723]. Стоит также упомянуть, что таким же прогерийным мышам даже высокожирная диета продлевала жизнь более, чем в 2 раза больше, чем будто "омоложение" факторами Яманаки [ncbi.nlm.nih.gov/pubmed/30548460]. Прогерийные мыши живут всего до 150 дней. Нормальные мыши живут до 1000 дней. Нормальным мышам высокожирная диета не продлевала максимальную продолжительность жизни. Эпигенетическое будто омоложение факторами Яманаки приводило к преждевременной смерти нормальных мышей из-за печеночной и кишечной недостаточности [biorxiv.org/content/10.1101/2022.05.27.493700v1] [nature.com/articles/s43587-022-00183-2].
- Пептиды Хавинсона вообще не продлевали жизнь долгоживущих мышей [pubmed.ncbi.nlm.nih.gov/19110597].
- Исследователи утверждают, что мухи будто бы быстрее старели из-за ограничения времени сна. Однако у них просто была повышена базовая уязвимость, но быстрее они не старели [link.springer.com/content/pdf/10.1186/1471-2202-11-56.pdf].
- Есть гипотеза, что сахарный диабет ускоряет старение людей. Как ее проверить? Также смотрим кривые выживания здоровых людей в сравнении с людьми с сахарным диабетом. Оказывается, что при сахарном диабете у людей наблюдается лишь параллельный сдвиг кривой выживания влево, без изменения угла наклона кривой, что говорит о влиянии сахарного диабета на базовую уязвимость. Но сахарный диабет не ускоряет старение человека, хотя и сокращает ожидаемую продолжительность жизни [pubmed.ncbi.nlm.nih.gov/34635124].
Итак, хватит примеров. Возникает вопрос о том, не все ли равно за счет чего увеличивалась продолжительность жизни - за счет базовой уязвимости, либо за счет скорости старения.
Дело в том, что увеличение продолжительности жизни за счет снижения базовой уязвимости - очень слабая стратегия. Например, пациенты, практикующие питание с низкой гликемической нагрузкой имеют в 2,15 раза меньший риск общей смертности при сахарном диабете, что эквивалентно дополнительным 7 годам жизни [ncbi.nlm.nih.gov/pubmed/25250626]. Мужчины из США, ведущие здоровый образ, жизни жили на 12 лет дольше, а женщины на 14 [pubmed.ncbi.nlm.nih.gov/29712712]. Все это стратегии снижения базовой уязвимости. То есть, если соединить вместе и здоровое питание, и физкультуру, и другие факторы индивидуально подобранного образа жизни, то получим для женщин прирост всего 14 лет жизни.
Рисунок 8 иллюстрировал изменение вероятности умереть в течение года в каждом возрасте. Однако, этот рисунок не учитывал "бутылочное горлышко" (понятие, заимствованное у Александра Фединцева). Как мы рассмотрим позже, в возрасте примерно 100 лет, популяция людей переживает так называемое "бутылочное горлышко", которое пока не удается преодолеть. Это означает следующее. при снижении базовой уязвимости в популяции людей в два раза, произойдет увеличение ожидаемой продолжительности жизни, но максимальная продолжительность жизни останется на том же уровне.
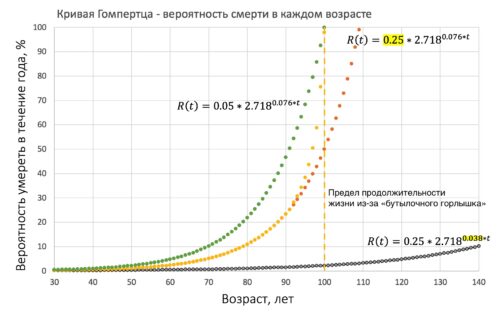 Рисунок 15. Формула, которая описывает закон Гомпертца, содержит две важные переменные: А - базовая уязвимость, а также G - скорость старения. Если базовую уязвимость (А) сократить в два раза (с 0.05 до 0.025), то кривая смертности Гомпертца сдвинется параллельно вправо (оранжевый цвет), что соответствует увеличению продолжительности ожидаемой жизни примерно на 10 лет. Однако, введено ограничение максимальной продолжительности жизни из-за эффекта "бутылочного горлышка". В результате максимальная продолжительности жизни не изменится (желтый цвет).
Рисунок 15. Формула, которая описывает закон Гомпертца, содержит две важные переменные: А - базовая уязвимость, а также G - скорость старения. Если базовую уязвимость (А) сократить в два раза (с 0.05 до 0.025), то кривая смертности Гомпертца сдвинется параллельно вправо (оранжевый цвет), что соответствует увеличению продолжительности ожидаемой жизни примерно на 10 лет. Однако, введено ограничение максимальной продолжительности жизни из-за эффекта "бутылочного горлышка". В результате максимальная продолжительности жизни не изменится (желтый цвет).
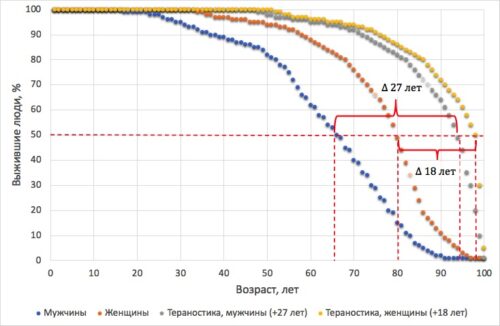 Рисунок 16. Синие (мужчины) и оранжевые (женщины) линии - кривые Каплана-Майера без учета младенческой смертности, построенные на основании анализа индивидуальных данных пациентов одного из лечебно-профилактических учреждений города Самары. Такой анализ не может быть репрезентативным для всей России, но на его основе можно показать приблизительную динамику смертности [demoscope.ru/weekly/2013/0539/analit03.php]. Серые (мужчины) и желтые (женщины) кривые Каплана-Майера построены гипотетически на основании модели, созданной Александром Фединцевым [afedintsev.shinyapps.io/mortality], прогнозирующей ожидаемую продолжительность жизни в зависимости от факторов образа жизни в стране с хорошим уровнем медицины. Согласно этой модели, ожидаемая продолжительность жизни мужчин - 95 лет, а женщин 98. Гипотетический прирост ожидаемой продолжительности жизни мужчин и женщин, имеющих доступ к европейскому образу жизни и хорошему уровню медицины, по сравнению с населением России составит 18-27 лет. Однако на графике отсутствует прирост максимальной продолжительности жизни. Это лишь приблизительные цифры, которые наглядно продемонстрируют примерную величину эффекта.
Рисунок 16. Синие (мужчины) и оранжевые (женщины) линии - кривые Каплана-Майера без учета младенческой смертности, построенные на основании анализа индивидуальных данных пациентов одного из лечебно-профилактических учреждений города Самары. Такой анализ не может быть репрезентативным для всей России, но на его основе можно показать приблизительную динамику смертности [demoscope.ru/weekly/2013/0539/analit03.php]. Серые (мужчины) и желтые (женщины) кривые Каплана-Майера построены гипотетически на основании модели, созданной Александром Фединцевым [afedintsev.shinyapps.io/mortality], прогнозирующей ожидаемую продолжительность жизни в зависимости от факторов образа жизни в стране с хорошим уровнем медицины. Согласно этой модели, ожидаемая продолжительность жизни мужчин - 95 лет, а женщин 98. Гипотетический прирост ожидаемой продолжительности жизни мужчин и женщин, имеющих доступ к европейскому образу жизни и хорошему уровню медицины, по сравнению с населением России составит 18-27 лет. Однако на графике отсутствует прирост максимальной продолжительности жизни. Это лишь приблизительные цифры, которые наглядно продемонстрируют примерную величину эффекта.
Далее мы рассмотрим причины такого ограничения (бутылочное горлышко), а ниже рассмотрим одно из свидетельств в пользу такого явления.
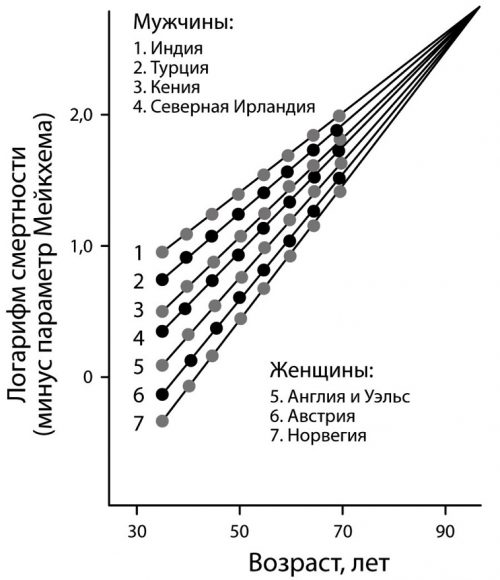 Рисунок 17. Сближение показателей смертности в различных популяциях в пожилом возрасте. На рисунке приведены графики, отражающие динамику показателей смертности в зависимости от возраста в разных странах [ncbi.nlm.nih.gov/pubmed/12867663].
Рисунок 17. Сближение показателей смертности в различных популяциях в пожилом возрасте. На рисунке приведены графики, отражающие динамику показателей смертности в зависимости от возраста в разных странах [ncbi.nlm.nih.gov/pubmed/12867663].
На графике видим, что в разных странах различная ожидаемая продолжительность жизни в разном возрасте, но пределы продолжительности жизни одинаковы - в одном и том же возрасте.
Из рисунков 15, 16 и 17 следует, что для того, чтобы увеличить максимальную продолжительность человека хотя бы за счет снижения базовой уязвимости, необходимо устранить "бутылочное горлышко". Именно поэтому, маловероятно, что методы, которые увеличивают продолжительность жизни за счет только лишь снижения базовой уязвимости (А), смогут увеличить видовой предел продолжительности жизни человека. Иными словами, не годятся для радикального увеличения продолжительности жизни. Далее мы рассмотрим дополнительные доказательства в пользу такой точки зрения.
Когда человек уже состарился, то без удаления "бутылочных горлышек", остановка старения уже не приведет к большому увеличению продолжительности жизни.
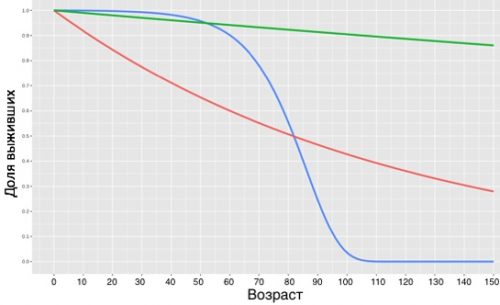
Так как человек уже достаточно стар, либо, иными словами, возрастной человек уже имеет достаточно высокую вероятности умереть в течение года. Но если старение остановить в юном возраста - в 20 лет, когда вероятность умереть в течение года еще очень мала, человек сможет прожить в среднем до 1000 лет, а максимально - намного дольше.
Рисунок 18. Кривые дожития стареющих и гипотетических нестареющих людей. Автор рисунка Александр Фединцев – биоинформатик. Синяя кривая - это популяция стареющих людей. Зеленая кривая - это нестареющие люди с риском смерти эквивалентным риску смерти 20-го человека. Красная кривая – это нестареющие люди с риском смерти эквивалентным риску смерти 60-го человека.
Мало вероятно, что комбинации методов, увеличивавших продолжительность жизни в экспериментах на мышах, смогут увеличить максимальную продолжительность жизни (МПЖ) человека, так как большинство этих комбинаций уже работают при сокращении калорийности рациона у мышей. А людям сокращение калорийности рациона дает эффект, аналогичный отсутствию ожирения, что не влияет на МПЖ человека, а лишь может улучшить здоровье
Если отельные методы увеличения продолжительности жизни мышей, связанные со снижением базовой уязвимости (А), без влияния на скорость старения (G), скорее всего, не увеличат максимальную продолжительность жизни людей, то возникает вопрос, позволят ли комбинации таких методов добиться большего. Допустим ученые создадут таблетку, которая запустит комбинацию эффектов: снизит ожирение, увеличит чувствительность к инсулину, снизит артериальное давление, уровень глюкозы, количество старых клеток, окислительный стресс, уровень воспаления, сократит риски сердечно-сосудистых и онкологических заболеваний, уменьшит эпигенетический возраст, активизирует фактор транскрипции FOXO, повысит уровень аутофагии, эффективность ремонта ДНК, митофагию, протеостаз, увеличит функцию стволовых клеток и так далее. Не важно, что читатель, вероятно, не понимает, что означают все эти замысловатые понятия.
 Важно то, что это все относится к признакам старения, открытым в результате экспериментов на мышах [ncbi.nlm.nih.gov/pubmed/23746838]. Хотите такую таблетку? Хорошо. Это не таблетка, но особый способ питания, позволяющий обеспечить перечисленные эффекты, уже существует. Называется он сокращение калорийности рациона питания.
Важно то, что это все относится к признакам старения, открытым в результате экспериментов на мышах [ncbi.nlm.nih.gov/pubmed/23746838]. Хотите такую таблетку? Хорошо. Это не таблетка, но особый способ питания, позволяющий обеспечить перечисленные эффекты, уже существует. Называется он сокращение калорийности рациона питания.
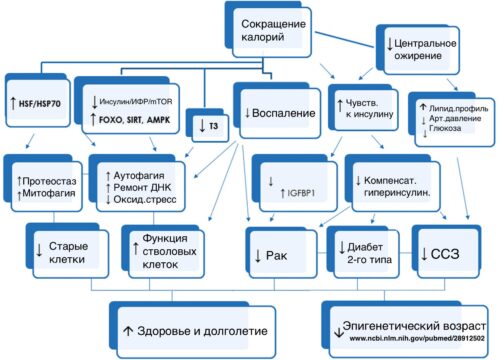
Рисунок 19. Схема описывает процессы, происходящие в организме в результате сокращения калорийности питания [ncbi.nlm.nih.gov/pubmed/27544442] [ncbi.nlm.nih.gov/pubmed/28912502].
На рисунке 19, видно, что все перечисленные выше комбинации эффектов, можно вызвать всего лишь сократив калорийность рациона питания. Вместо того, чтобы исследовать "бутылочные горлышки", ограничивающие продолжительность жизни человека, большая часть всех механизмов увеличения продолжительности жизни была открыта учеными, благодаря изучению сокращения калорийности рациона питания у мышей. Однако даже сокращение калорийности рациона питания в экспериментах на мышах не замедляло скорость старения животных воспроизводимо.
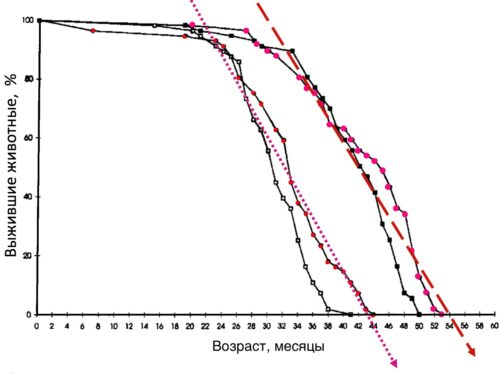 Рисунок 20. Кривые выживания мышей, которые с юного возраста имели сокращенный на 40% по калорийности рацион питания (CR), и мышей, которым не ограничивали количество калорий (AL). Розовым маркером маркированы кривые выживания самцов мышей, а черным - самок. Максимальная продолжительность жизни самцов CR больше на 21,5%. Однако сокращение калорийности питания не позволило значительно изменить угол наклона кривой выживания мышей (CR), что говорит о влиянии лишь на базовую уязвимость (A). Сокращение калорийности питания не оказало влияния на скорость старения [ncbi.nlm.nih.gov/pubmed/7501958].
Рисунок 20. Кривые выживания мышей, которые с юного возраста имели сокращенный на 40% по калорийности рацион питания (CR), и мышей, которым не ограничивали количество калорий (AL). Розовым маркером маркированы кривые выживания самцов мышей, а черным - самок. Максимальная продолжительность жизни самцов CR больше на 21,5%. Однако сокращение калорийности питания не позволило значительно изменить угол наклона кривой выживания мышей (CR), что говорит о влиянии лишь на базовую уязвимость (A). Сокращение калорийности питания не оказало влияния на скорость старения [ncbi.nlm.nih.gov/pubmed/7501958].
Более того, у мышей сокращение калорийности рациона питания защищает от избытка энергии при жизни в клетках. Но это, скорее всего, не произойдет в естественных условиях. В условиях проживания мышей в стрессовых условиях, например, когда температура окружающей среды выше или ниже комфортной, сокращение калорийности рациона питания может даже сократить продолжительности жизни животных [biorxiv.org/content/10.1101/2022.10.17.512576v1].
Сокращение калорийности рациона питания уже почти не увеличивало максимальную продолжительность жизни долгоживущим макакам резусам, которые проживали в Национальном парке [pubmed.ncbi.nlm.nih.gov/28094793]. А исследования на людях позволяют предположить, что вся польза сокращения потребления калорий у людей без недоедания – это способ избежать ожирения. Этим и ограничена вся его польза. Самое сильное ожирение отнимает до 10 лет жизни [ncbi.nlm.nih.gov/pubmed/19299006]. Если это так, то достаточно иметь идеальную талию, и на этом все достижения биологии старения, полученные в результате изучения мышей, в основном и заканчиваются [ncbi.nlm.nih.gov/pubmed/27544442]. Иными словами, человек с ожирением похудением может вернуть к ожидаемой продолжительности жизни от 1 до 10 утраченных лет, но это никак не влияет на максимальную продолжительность жизни человека, так как супердолгожители и так были стройными.
Пора переходить от исследований биологии старения мышей к исследованиям биологии старения человека. Люди потому и живут долго, что большинство известных проблем, ограничивающих жизнь коротко живущих животных, биология человека уже решила
У всех животных причины старения разные. То, что убивает мышь в 2-х летнем возрасте, не убивает человека, так как мы уже к этим причинам адаптировались. Хотя мы и наблюдаем похожее явление у животных, это не какой-то универсальный для животных процесс. Вероятно, поэтому поиск единой причины старения для животных ничем до сих пор не увенчались, а некоторые авторы вообще предлагают отказаться от термина старения, чтобы не путаться [pubmed.ncbi.nlm.nih.gov/32949595]. Например, в 2007 году октябрьский номер журнала Aging cell взволновал умы всех биологов мира. Группе американских исследователей из Арканзасского медицинского университета под руководством Роберта Шмуклера Райса за счет всего одного изменения в гене age-1, влияющего на передачу сигнала инсулин подобного фактора роста 1-го типа (ИФР-1) удалось продлить жизнь червям нематодам в 10 раз [ncbi.nlm.nih.gov/pubmed/17996009] и значительно замедлить скорость старения. Однако аналогичные вмешательства, влияющие также на ИФР-1 сигналинг, продлевали мышам линии B6C3F1 максимальную продолжительность жизни всего на 20% без влияния на скорость старения [ncbi.nlm.nih.gov/pubmed/7501958]. А самым долгоживущим мышам, максимальная продолжительность жизнь которых составляет 1500 дней, аналогичное вмешательство, влияющее также на ИФР-1 сигналинг, вообще не продлевало жизнь ни на сколько [ncbi.nlm.nih.gov/pubmed/27605408], или даже сокращало жизнь. А люди живут намного дольше мышей, и многие из людей уже имеют оптимальный ИФР-1 сигналинг [ncbi.nlm.nih.gov/pubmed/18316725]. И если мыши с синдромом Ларона (дефицит рецепторов гормона роста и низкий уровень ИФР-1) живут рекордно долго [ncbi.nlm.nih.gov/pubmed/7501958], то продолжительность жизни людей с синдромом Ларона такая же, как в аналогичной популяции [ncbi.nlm.nih.gov/pubmed/21325617]. Не похоже, что синдром Ларона продлевает жизнь людей. А атеросклероз у людей с синдромом Ларона встречается даже чаще, хотя и не встречается смерть от рака.
Крысы со сниженной на 33% функцией щитовидной железы (индуцированный гипотиреоз) живут дольше [ncbi.nlm.nih.gov/pubmed/6632988]. А у голого землекопа вообще критически низкий уровень гормонов щитовидной железы. Но у людей низкий уровень гормонов щитовидной железы сокращает продолжительность жизни. Существует множество терапий, которые лечат мышиные деменции, похожие на болезнь Альцгеймера, которой болеют старые люди. Но ни одна из этих терапий не оказалась эффективной для лечения возрастной деменции у людей. Утрата функции микроглии, которая, как предполагают, может быть причиной болезни Альцгеймера, обнаружена у людей, так как люди долго живут, но не найдена у грызунов. Это ставит под вопрос изучение болезни Альцгеймера на моделях мышей и крыс [pubmed.ncbi.nlm.nih.gov/31922322] [pubmed.ncbi.nlm.nih.gov/34571885].
С возрастом сосуды и у мышей, и у людей становятся все жесте. Однако решающее значение в нарастании жесткости сосудов у мышей и людей имеют разные конечные продукты гликирования. У людей - это, вероятно, глюкозепан. Глюкозепана в коллагене человека в 100 раз больше, чем всех других сшивок у человека [ncbi.nlm.nih.gov/pubmed/26049074]. К 80 годам – это 40-60% сшивок в коже и в сосудах человека [jbc.org/content/280/13/12310.full] [ncbi.nlm.nih.gov/pubmed/15677467]. Так уже к 30-40 лет у человека концентрация глюкозепана 1500 пмоль/мг [ncbi.nlm.nih.gov/pubmed/23787467]. А у крыс, которые в среднем живут около 2 лет, к возрасту одного года глюкозепан составляет всего 100 пмоль/мг [ncbi.nlm.nih.gov/pubmed/23787467], так как не успевает накопиться значительно к этому возрасту. Но уже у долгоживущих грызунов, которые живут более 10 лет, например, у Ansell’s слепыша, также глюкозепан выходит на первые роли [ncbi.nlm.nih.gov/pubmed/22156473].
Почему модели мышей для поиска терапий восстановления иммунитета чаще всего не работают на людях? Диабет 1-го типа - это аутоиммунное заболевание, которое у мышей было предотвращено или обращено вспять сотни раз, но на сегодняшний день у людей эта болезнь до сих пор не лечится. Иммунология, если она продолжит фокусироваться на мышах, а не на людях, может испытать глубокий кризис, стать интересной биологией, но не иметь отношения к медицине. Вероятно, существуют новые иммунологические механизмы у долгоживущих, менее плодовитых млекопитающих, таких как люди, поскольку они должны оставаться здоровыми гораздо дольше, чем короткоживущие грызуны, чтобы вид выжил, порой приобретая аутоиммунные заболевания в качестве "жертвы" для усиления иммунной реакции, чтобы не умереть от инфекций [pubmed.ncbi.nlm.nih.gov/29490162].
Удаление стареющих клеток у мышей увеличило медианную продолжительность жизни на 18% [pubmed.ncbi.nlm.nih.gov/26840489], хотя и не влияло на скорость их старения [pubmed.ncbi.nlm.nih.gov/27638422]. Однако, чем дольше живут животные, тем больше их клетки склонны к старению для защиты от мутаций [pubmed.ncbi.nlm.nih.gov/31098949]. В настоящий момент известна и вредная, и парадоксально полезная роль стареющих клеток в организме [pubmed.ncbi.nlm.nih.gov/29374361]. Стареющие клетки могут не только способствовать фиброзу, но и тормозить фиброз тканей [pubmed.ncbi.nlm.nih.gov/18724938]. У эмбрионов старые клетки необходимы для заживления ран. Старые клетки могут защищать печень и сосуды от фиброза, берут на себя 90% роли очистки организма от вирусов, поглощают холестерин ЛПНП, контролируя сердечно-сосудистый риск, компенсируют в печени утраченную с возрастом функцию очистки. Удаление старых клеток может, наоборот ускорить старение из-за интоксикации и фиброза в печени, нарушения барьеров в кровеносных сосудах. Было показано, что удаленные старых клеток кровеносных сосудов не заменяются новыми, а вместо этого активируется фиброз сосудов. Может даже оказаться, что удалять старые клетки - это хуже, чем оставлять их накапливаться [pubmed.ncbi.nlm.nih.gov/32485135].
Мышам добавки омега-3 жирных кислот сокращают продолжительность жизни [ncbi.nlm.nih.gov/pubmed/24816553] [ncbi.nlm.nih.gov/pubmed/20621447]. А для человека добавки омега-3 не сокращают продолжительность жизни, но и не продлевают - нейтральны [cochranelibrary.com/cdsr/doi/10.1002/14651858.CD003177.pub3/full].
Как видим, эффективность методов продления жизни мышей и крыс не воспроизводятся на людях.
Долгоживущие животные, проживающие в оптимальных условиях, вероятно, уже исчерпали ресурс продления жизни за счет снижения базовой уязвимости. Это относится и к человеку, который живет в условиях хорошей гигиены, безопасности и имеет медицинское обслуживание
 Рисунок 21. В центре долгоживущая мышь линии GHR-KO [pubmed.ncbi.nlm.nih.gov/29378959].
Рисунок 21. В центре долгоживущая мышь линии GHR-KO [pubmed.ncbi.nlm.nih.gov/29378959].
Мышам дикого типа с максимальной продолжительностью жизни 1000-1200 дней, сокращение калорийности питания, либо рапамицин увеличивали продолжительность жизни. Однако, сокращение калорийности рациона питания или циклы голоданий уже не продлевали жизнь долгоживущих мышей линии GHR-KO, максимальная продолжительность жизни которых составляет 1400-1500 дней [ncbi.nlm.nih.gov/pubmed/27688483] [ncbi.nlm.nih.gov/pubmed/19747233]. Вероятно, долгоживущие мыши уже исчерпали свой ресурс продления жизни за счет снижения базовой уязвимости (А). В том числе терапия рапамицином вместо продления жизни, наоборот сократила на 12-13% продолжительность жизни долгоживущих мышей линии GHR-KO [pubmed.ncbi.nlm.nih.gov/29378959].
 Оптимальное здоровье можно создать не только генетикой, но и условиями проживания. Так известно, что животные в неволе живут чаще всего дольше, чем в дикой природе, так как получают медицинскую помочь, проживают в условиях с лучшей гигиеной, регулярным питанием, защищены от гибели из-за сражений или травм.
Оптимальное здоровье можно создать не только генетикой, но и условиями проживания. Так известно, что животные в неволе живут чаще всего дольше, чем в дикой природе, так как получают медицинскую помочь, проживают в условиях с лучшей гигиеной, регулярным питанием, защищены от гибели из-за сражений или травм.
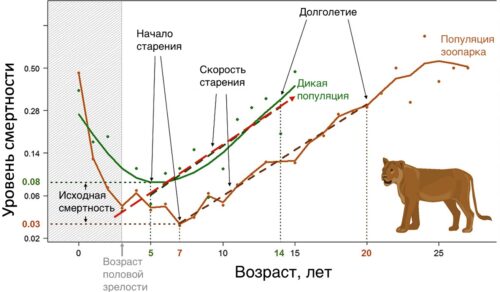
Рисунок 22. Самки львов в популяции зоопарка живут дольше, чем в диких условиях, за счет снижения базовой уязвимости, но имеют примерно одинаковую скорость старения [pubmed.ncbi.nlm.nih.gov/27819303].
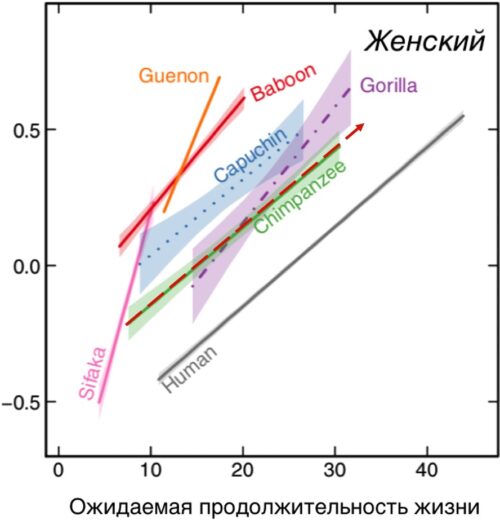 Люди потому и живут долго, что, вероятно, все проблемы, ограничивающие жизнь короткоживущих мышей и даже высших приматов, биология человека уже решила. Например, в сравнении с шимпанзе люди не стали медленнее стареть. Ожидаемая продолжительность жизни людей по сравнению с шимпанзе выросла за счет сокращения смертности, не зависящей от возраста (в результате улучшения условий жизни и медицины).
Люди потому и живут долго, что, вероятно, все проблемы, ограничивающие жизнь короткоживущих мышей и даже высших приматов, биология человека уже решила. Например, в сравнении с шимпанзе люди не стали медленнее стареть. Ожидаемая продолжительность жизни людей по сравнению с шимпанзе выросла за счет сокращения смертности, не зависящей от возраста (в результате улучшения условий жизни и медицины).
Рисунок 23. Данные о возрастных показателях смертности в нескольких популяциях разных родов приматов и людей. Различия в продолжительности жизни между разными животными обусловлены различной скоростью старения, либо условиями жизни. Наблюдается лишь параллельный сдвиг серой кривой смертности людей (женщины) вправо, без изменения угла наклона кривой по отношению к кривой смертности шимпанзе, что говорит о влиянии лишь на базовую уязвимость (A) [pubmed.ncbi.nlm.nih.gov/34135334].
А что, если применить для человека самые эффективные методы продления жизни мышам. Например, мыши с нокаутом в генах, кодирующих рецепторы гормона роста, приводящим к дефициту гормона роста, не уступают по продолжительности жизни мышам с сокращенным рационом калорийности питания. А сокращение калорийности рациона питания таким мышам уже ничего не добавляет в плане продления жизни [pubmed.ncbi.nlm.nih.gov/15536017].
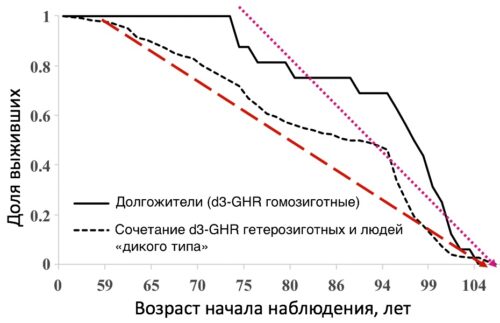 Увеличится ли максимальная продолжительность жизни человека, если выключить работу гена, кодирующего рецепторы гормона роста? К сожалению - нет.
Увеличится ли максимальная продолжительность жизни человека, если выключить работу гена, кодирующего рецепторы гормона роста? К сожалению - нет.
Рисунок 24. Люди с делецией в генах, кодирующих рецепторы гормона роста, имеют повышенную чувствительность к гормону роста, сниженный уровень самого гормона. Их ожидаемая продолжительность жизни на 10 лет больше, чем в популяции. Однако максимальная продолжительность жизни таких людей такая же, как в популяции [pubmed.ncbi.nlm.nih.gov/28630896].
Таким образом даже самые эффективные методы продления жизни не долгоживущим мышам, вероятно, не позволят преодолеть видовой барьер продолжительности жизни человека.
Улучшение функции митохондрий, эпигенетический откат, сокращение калорийности рациона питания, нокаут генов или активация генов, изученных на мышах, удлинение теломер, удаление старых клеток, доноры NAD+ и др. - все это продлит жизнь тем, кто является мышью, но не позволит преодолеть видовой предел продолжительности жизни человека.
Если ученый будет упираться в публикацию научной статьи с новой прорывной теорией, ему придется работать над одной статьей многие годы. Это не способствует росту его карьеры. В результате огромное количество статей приводит не к смене центральных идей в науке, а скорее к окостенению канона и отсутствию научного прогресса
Йохан и Джеймс из калифорнийского университета по итогам исследования [pnas.org/doi/10.1073/pnas.2021636118] пишут: «Изучив 1,8 миллиарда ссылок на 90 миллионов статей по 241 теме, мы обнаружили». И вот их краткие выводы:
- Огромное количество статей приводит не к смене центральных идей в науке, а скорее к окостенению канона
- Ученые в тех областях науки, где ежегодно публикуется множество работ, сталкиваются с трудностями при публикации, чтении и цитировании, если только их работы не ссылаются на уже широко цитируемые статьи
- Из-за этого новые работы, содержащие потенциально важный вклад в науку, не могут привлечь внимание всей научной области
- В результате такие работы, опирающиеся на ложные, устаревшие теории копятся в большом количестве, создавая порочный круг
Иными словами, если ученый хочет иметь быстрый карьерный рост, то на его работы должны часто ссылаться другие ученые. Для этого он должен публиковать, как можно больше статей. Но если ученый будет упираться в публикацию научной статьи с новой прорывной теорией, которая переворачивает все научное представление, ему придется работать только над одной статьей порой многие годы. Это не способствует росту его карьеры.
В результате, многие ученые мира играют в науку понарошку.
На физическом уровне старение - это постепенное нарастание жесткости, потеря эластичности тканей, окружающих клетки организма
Нужно ли искать физическую причину старения в клетках организма? Ведь, мы часто читаем о том, что ученые омолодили клетки. Долгое время считалось, что продолжительность жизни организма ограничивается продолжительностью жизни его клеток. Одни и те же гемопоэтические стволовые клетки мышей могут жить 3000 дней, когда их пересаживают по мере старения мыши от старой к молодой особи, что в несколько раз дольше, чем максимальная продолжительность жизни животного [ncbi.nlm.nih.gov/pubmed/37377], а также мезенхимальные стволовые клетки мыши могут омолаживаться при пересадке в новый внеклеточный матрикс, а в старой среде быстро стареют [doi.org/10.1016/S0262-4079(11)62200-8]. Получается, что клетки не ограничивают продолжительность жизни мышей? Если нет, тогда что ограничивает? Наш организм состоит не только из клеток, но и из среды, которая окружает клетки. Такая среда имеет название внеклеточный матрикс. И вот увеличение жесткости и потеря эластичности внеклеточного матрикса с возрастом вызывают изменение работы клеток, которые приобретают стареющий фенотип. Таким образом на физическом уровне старение - это постепенное нарастание жесткости, потеря эластичности тканей, окружающих клетки организма в том числе из-за сшивания волокон сшивками [ncbi.nlm.nih.gov/pubmed/32540391] [pubmed.ncbi.nlm.nih.gov/33688918].
Нарастающая жесткость внеклеточного матрикса с возрастом является причиной старения клеток иммунитета [pubmed.ncbi.nlm.nih.gov/27876574], причиной, почему фиброз легких у старых мышей не обратим в отличии от молодых [pubmed.ncbi.nlm.nih.gov/33688918].
Клетки нервной ткани или мышечные имеют одинаковый код ДНК. Тогда почему они разные? Внеклеточный матрикс управляет дифференцировкой клеток [pubmed.ncbi.nlm.nih.gov/29212889]. Чем больше воды и меньше коллагена во внеклеточном матриксе, тем мягче ткань, окружающая клетку. А клетки этой ткани дифференцируются в клетки для данной ткани. Внеклеточный матрикс решает будет ли стволовая клетка дифференцирована в нервную, костную, мышечную и т.д. через сигналы жесткости.
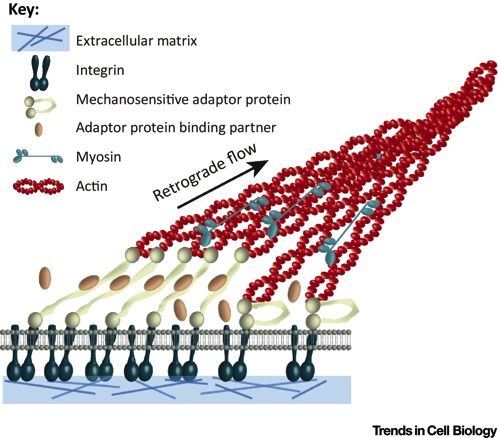
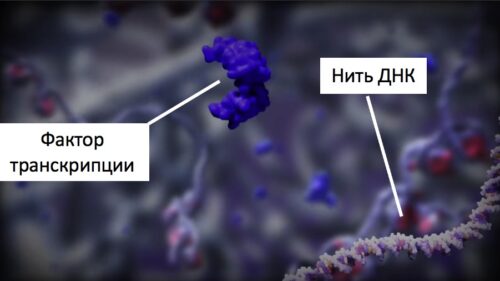 Рисунок 25. Фактор транскрипции и нить ДНК внутри ядра клетки.
Рисунок 25. Фактор транскрипции и нить ДНК внутри ядра клетки.
Дело в том, что какая информация будет считываться с кода ДНК клетки – зависит от факторов транскрипции (их известно около 1500). Каждый фактор транскрипции умеет читать определенный участок ДНК. От того, какие факторы транскрипции будут высвобождаться для чтения кода ДНК, зависит то, какой станет клетка. Внеклеточный матрикс через механорецепторы на поверхности клеток передает сигналы жесткости внутрь клетки. Затем нити миозина натягивают актиновый скелет внутри клетки, стимулируя, сокращение клетки. Через комплекс LINC сигнал о натяжении передается в ядро, хроматин в ядре клетки растягивается, повышая доступность для ферментов, работа факторов транскрипции меняется [pubmed.ncbi.nlm.nih.gov/33810253]. Таким образом жесткость внеклеточного матрикса управляет факторами транскрипции и работой генов [pubmed.ncbi.nlm.nih.gov/29212889] [pubmed.ncbi.nlm.nih.gov/29510460][pubmed.ncbi.nlm.nih.gov/33810253].
Жизнь клетки полностью зависит от физических свойств внеклеточного матрикса. Если произвести полное удаление всех сигналов жесткости на клетку извне, то клетка самоуничтожается [pubmed.ncbi.nlm.nih.gov/29510460].
Жесткая и неэластичная внеклеточная среда заставляет молодые клетки становиться старыми. А выращивание старых клеток на более мягкой и эластичной внеклеточной среде приводит к их омоложению. Сяо Дон Чэнь из Техасского Университета взяла мезенхимальные стволовые клетки у 3-х и у 18-месячных мышей. Когда клетки молодых мышей выращивали на старом внеклеточном матриксе, то молодые клетки старели. А когда клетки старых мышей выращивали на молодом внеклеточном матриксе, то старые клетки снова становились молодыми [doi.org/10.1016/S0262-4079(11)62200-8].
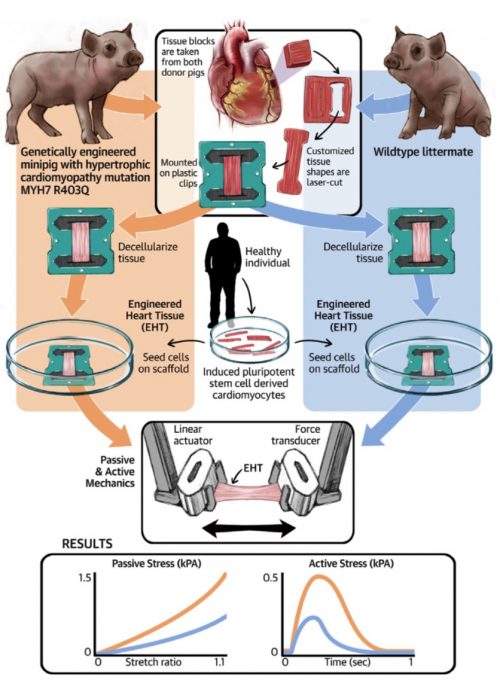 Если жесткая и неэластичная внеклеточная среда заставляет молодые клетки становиться старыми, то могут ли стволовые клетки омолаживать сердце?
Если жесткая и неэластичная внеклеточная среда заставляет молодые клетки становиться старыми, то могут ли стволовые клетки омолаживать сердце?
Рисунок 26. Подозревая, что виновником является нездоровый внеклеточный матрикс, команда Кэмпбелла впервые получила больной внеклеточный матрикс сердечной мышцы от модели свиньи с гипертрофической кардиомиопатией сердца.
pubmed.ncbi.nlm.nih.gov/31468004
Клетки сердца свиньи были химически удалены из ткани (остался лишь внеклеточный матрикс сердца свиньи) и заменены здоровыми клетками сердечной мышцы человека, которые были получены из плюрипотентных столовых клеток человека. К удивлению многих, здоровые клетки сердца человека, которые росли на здоровом внеклеточном матриксе свиньи, сделали здоровую сердечную ткань. Однако здоровые клетки сердца человека, которые росли на больном внеклеточном матриксе свиньи, произвели сердечную мышечную ткань с признаками гипертрофической кардиомиопатии. То есть полностью здоровые клетки ничего не дали, а здоровье сердца диктовал внеклеточный матрикс. Это действительно удивительно, потому что эти клетки содержат такую же генетику, и все же у них совершенно другое поведение, благодаря тому на каком внеклеточном матриксе они росли. Как будто больной внеклеточный матрикс помнит, что до этого он был частью нездорового сердца. Вот почему, стволовые клетки бессильны в омоложении.
Именно поэтому все эксперименты, направленные на лечение больного сердца человека стволовыми клетками "провалились" - не было показано, что такая терапия может продлевать жизнь людям. А иначе зачем это нужно?
Если на физическом уровне старение - это постепенное нарастание жесткости и потеря эластичности тканей, в том числе из-за сшивания волокон коллагена внеклеточного матрикса сшивками [ncbi.nlm.nih.gov/pubmed/32540391] [pubmed.ncbi.nlm.nih.gov/33688918], то какие именно сшивки имеют решающее значение для человека? У людей - это, вероятно, глюкозепан. Глюкозепана в растворимой части коллагена кожи и сосудов человека в 100 раз больше, чем всех других сшивок у человека [ncbi.nlm.nih.gov/pubmed/26049074]. К 80 годам – это 40-60% сшивок в коже и в сосудах человека [jbc.org/content/280/13/12310.full] [ncbi.nlm.nih.gov/pubmed/15677467]. Так уже к 30-40 лет у человека концентрация глюкозепана 1500 пмоль/мг [ncbi.nlm.nih.gov/pubmed/23787467]. А у крыс, которые в среднем живут около 2 лет, к возрасту одного года глюкозепан составляет всего 100 пмоль/мг [ncbi.nlm.nih.gov/pubmed/23787467], так как не успевает накопиться значительно к этому возрасту. Поэтому мало смысла в изучении сшивок короткоживущих животных. Но уже у долгоживущих грызунов, которые живут более 10 лет, например, у Ansell’s слепыша, также глюкозепан выходит на первые роли [ncbi.nlm.nih.gov/pubmed/22156473].
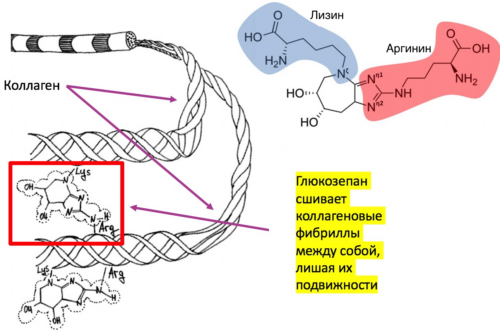 Рисунок 27. Две аминокислоты (лизин и аргинин) могут прикрепляться к отдельным молекулам коллагена и образовывать межмолекулярную сшивку – глюкозепан. Глюкозепан сшивает коллагеновые фибриллы между собой, лишая их подвижности
Рисунок 27. Две аминокислоты (лизин и аргинин) могут прикрепляться к отдельным молекулам коллагена и образовывать межмолекулярную сшивку – глюкозепан. Глюкозепан сшивает коллагеновые фибриллы между собой, лишая их подвижности
ncbi.nlm.nih.gov/pubmed/24060753
В будущем мы, вероятно, научимся разбивать глюкозепановые сшивки внеклеточного матрикса, чтобы сделать его менее жестким. Дэвид Шпигель из Йельского Университета заявил о получении первых небольших результатов в этом направлении, создав фермент, разбивающий глюкозепановые сшивки [doi.org/10.2337/db18-1229-P]. Однако для разрушения глюкозепана внутри организма нужна малая молекула, а фермент - это слишком большая молекула. Дело в том, что глюкозепан - это, в сущности, молекула "сахара". Сахар — это небольшая молекула, способная поместиться в узкие промежутки между коллагеновыми волокнами. Когда глюкозепан сшивает волокна коллагена, то они притягиваются еще более плотно друг к другу, затвердевая и придавая жесткость коллагену. Ферменты — это гораздо более крупные молекулы, чем сахара. Некоторые ферменты могут деградировать коллаген снаружи, но никакой фермент, разрушающий перекрестные сшивки, физически не может проникнуть внутрь структур из коллагена, куда может проникнуть только малая молекула размером не более, чем сам глюкозепан [ncbi.nlm.nih.gov/pubmed/16706655].
До 2020 года о роли внеклеточного матрикса в старении хоть и упоминали другие исследователи, но никто не мог объяснить механизм, благодаря которому стохастические неферментативные модификации долгоживущих макромолекул внеклеточного матрикса вызывают старение организма. В 2020 году в научном журнале «Ageing Research Reviews» Александром Фединцевым и Алексеем Москалевым опубликована статья об этом неучтенном ранее механизме старения [sciencedirect.com/science/article/pii/S1568163720302324]. И уже в 2022 году эта теория официально пополнила список, пока еще признаков старения. А значит наука начнет двигаться в эту сторону [pubmed.ncbi.nlm.nih.gov/35347083].
Таким образом заслуга в описании самой правдоподобной теории старения принадлежит Radical life extension (RLE) group [https://rle4.life] - группа ученых и аналитиков.
Когда мы понимаем, в каком возрасте находится предел продолжительности жизни человека, то это позволяет точнее понять, что именно людям не позволяет жить дольше
Когда мы понимаем, в каком возрасте находится предел продолжительности жизни человека, то это позволяет точнее понять, что именно людям не позволяет жить дольше, чтобы искать способы устранить эту причину. В противном случае, если верить в возраст недостоверных долгожителей, причину старения будет также сложно найти, как и иглу в стоге сена.
Максимальная продолжительность жизни (МПЖ) человека - это максимально большой возраст, в котором умер самый долгоживущий человек на планете.
Ожидаемая продолжительность жизни (ОПЖ) человека - это значение средней продолжительности предстоящей жизни, прогнозируемое в предположении, что уровни смертности населения во всех возрастах в будущем останутся такими же, как в рассматриваемом году. Смотрите рисунок.
С 1860 по 1990 годы наблюдался рост МПЖ со 101 года до 108 лет. Однако МПЖ людей за последние 23 года не изменилась [pubmed.ncbi.nlm.nih.gov/27706136]. Также почти перестала расти ожидаемая продолжительность жизни человека (ОПЖ). По оценкам авторов исследования [pubmed.ncbi.nlm.nih.gov/27706136] ожидаемая продолжительность жизни не превысит 85 лет. Если наука не научится влиять на скорость старения людей, то продолжительность жизни человека скоро достигнет своего предела на уровне ОПЖ = 85 лет.
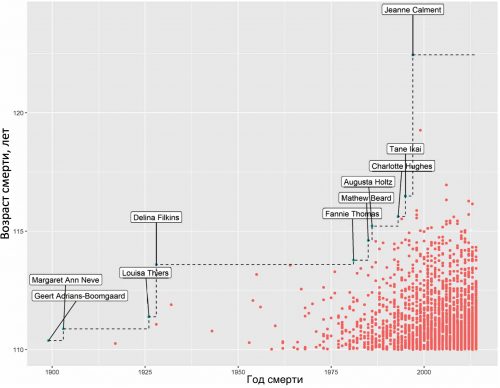
Рисунок 28. Динамика роста рекордов продолжительности жизни людей с 1899 по 2014 годы [pubmed.ncbi.nlm.nih.gov/30870458]. Каждая точка обозначает смерть, а синие точки указывают на возраст установления рекорда [pubmed.ncbi.nlm.nih.gov/30870458]. Быстрый рост числа долгожителей с середины 1970-х годов.
И кажется, что МПЖ уже достигла 122 лет на примере Жанны Кальман. Обратите внимание на быстрый рост числа долгожителей с середины 1970-х годов. Первым подтвержденным долгожителем был голландец Герт Адрианс-Бумгаард, который умер в Нидерландах в 1899 году. Впоследствии было установлено 9 других рекордсменов, включая Жанну Кальман, которая является нынешним рекордсменом.
Исследователи Anthony Medford и James W Vaupel из Университета Южной Дании построили модель, которая позволяет посчитать, какова вероятность, что рекорд в 122 года еще не побит [pubmed.ncbi.nlm.nih.gov/30870458]. Их результаты показали, что вероятность наблюдения нового рекорда за время, прошедшее с момента последнего, составляла 75%. Иными словами, рекорд Жанны Кальман с вероятностью на 75% должен уже был быть побит еще несколько лет назад. Но этого не произошло. Это ставит под сомнение достоверность такового рекорда. Николай Зак (математик из МГУ) сразу обнаружил математическое несоответствие рекорда 122 года и опубликовал результаты расследования. Оказалось, что Жанна Кальман умерла еще в 1934 году в возрасте 58 лет. А новой Жанне Кальман на момент смерти было всего 99 лет, а не 122 [kp.ru/daily/26977.3/4034526].
Также по результатам расследования Николая Зака не существовали и многие другие рекорды, превышающие примерно 115-летний возраст. Поэтому, вероятно, прогнозы и не сбываются. Это большая проблема, так как 100 лет назад возраст рождения плохо учитывался. Вероятность ошибок велика. Регистрация возраста рождения в Соединенных Штатах вводилась постепенно, и только шесть штатов имели официальную регистрацию рождения в период с 1841 по 1890 годы. Например, Кестенбаум и Фергюсон смогли найти только 52 свидетельств о рождении долгожителей из 325, тогда как возраст остальных 256 человек был подтвержден в ходе ранних переписей населения США. После проведения прямой процедуры проверки возраста для записей лиц, родившихся в 1900 году и в возрасте 106 лет и старше, связав данные, имеющиеся в главном файле смерти Управления социального обеспечения США с ранними переписями, было обнаружено, что очистка данных (удаление записей с неподтвержденным возрастом) привела к более высоким оценкам смертности в пожилом возрасте - к меньшей продолжительности жизни. Доля записей с неподтвержденным возрастом увеличивается с возрастом от 12% в возрасте 100 лет до 17% в возрасте 105 лет, и 35% в возрасте 109 и более. Леонид Гаврилов в своей работе [ncbi.nlm.nih.gov/pubmed/12867663] делает вывод о сомнительности данных по возрасту смерти долгожителей из когорты людей, рожденных в США до 1880 года.
Превышение верхнего предела ОПЖ 85 лет для населения страны (мужчин и женщин вместе взятых) потребует изменения биологической скорости старения. В противном случае мы упираемся в предел [pubmed.ncbi.nlm.nih.gov/27706136]. Это также означает, что примерно 40% исходной когорты рожденных доживут как минимум до 90 лет; 5–6% доживут до 100 лет; ожидается, что небольшой процент когорты достигнет возраста 110–115 лет. Поэтому неудивительно, что рост продолжительности жизни в развитых странах в последние десятилетия замедлился и начал выравниваться ниже 85 лет [pubmed.ncbi.nlm.nih.gov/31001621].
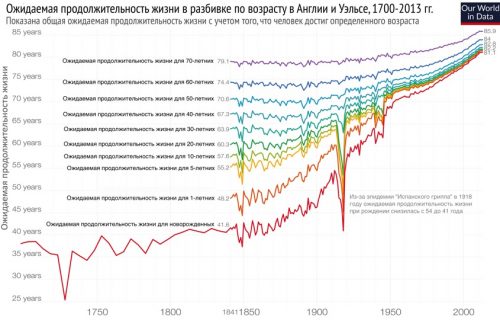
Рисунок 29. К сожалению, как показано на следующем графике [pubmed.ncbi.nlm.nih.gov/28848187], за последние годы удалось снизить смертность среди людей в возрастах 60, 70, 80, 90 лет. Но у тех, чей возраст достигает 100 лет, снизить смертность уже не удается. А в возрасте около 115 лет возникает какой-то непреодолимый предел продолжительности жизни человека.
Рисунок 30. Медицина справляется с задачей увеличения ожидаемой продолжительности жизни в более ранних возрастах человека. Так ожидаемая продолжительности жизни в Европе выросла лет на 20 в сравнении с 19 веком, даже с учетом высокой детской смертности. Однако, чем старше люди, тем все сложнее увеличь им продолжительности жизни из-за приближения к предельному возрасту жизни человека.
ourworldindata.org/its-not-just-about-child-mortality-life-expectancy-improved-at-all-ages
Превышение верхнего предела ожидаемой продолжительности жизни свыше 85 лет потребует изменения скорости старения [pubmed.ncbi.nlm.nih.gov/2770613] [pubmed.ncbi.nlm.nih.gov/31001621].
Приблизительный верхний предел продолжительности жизни человека ограничивается на отметке 100-120 лет эластичными свойствами сердца, артерий, и системы дыхания
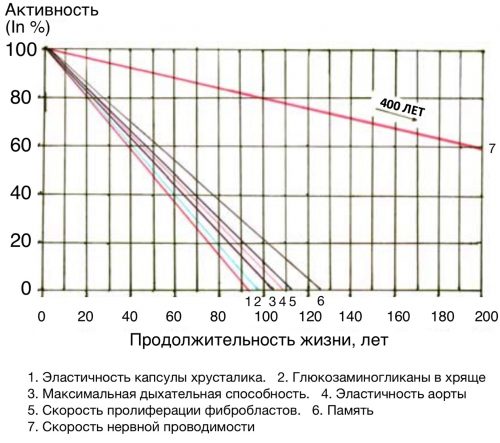 Рисунок 31. Старение частей организма. Возрастное снижение нескольких физиологических функций с указанием приблизительного возраста, когда функции достигнут нулевого уровня [pubmed.ncbi.nlm.nih.gov/18175202]. Мы видим, как на отметках от 93 до 110 лет эластичность различных частей тела утрачивается.
Рисунок 31. Старение частей организма. Возрастное снижение нескольких физиологических функций с указанием приблизительного возраста, когда функции достигнут нулевого уровня [pubmed.ncbi.nlm.nih.gov/18175202]. Мы видим, как на отметках от 93 до 110 лет эластичность различных частей тела утрачивается.
Приблизительный верхний предел продолжительности жизни человека ограничивается на отметке 100-120 лет эластичными свойствами сердца, артерий, и системы дыхания. [pubmed.ncbi.nlm.nih.gov/18175202]. И максимальная дыхательная способность, и эластичность аорты зависят от эластина. Когда эластичность утрачивается, то человек не может дышать, а сердце не может адекватно работать.
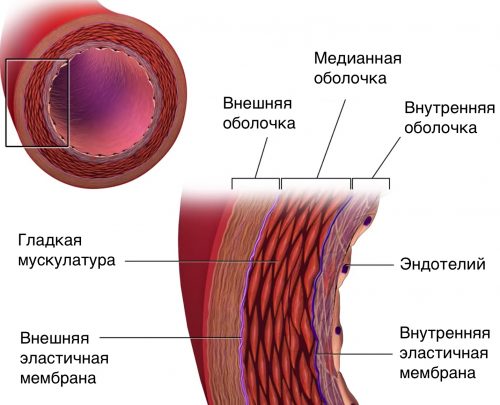 Рисунок 32. Строение артерии. Артерии в основном состоят из матричных белков (эластина и коллагена), гладкомышечных клеток и гликозаминогликанов.
Рисунок 32. Строение артерии. Артерии в основном состоят из матричных белков (эластина и коллагена), гладкомышечных клеток и гликозаминогликанов.
При старении происходит утолщении внутренней и медианой оболочки даже без атеросклеротических бляшек, артерии становятся более жесткими и менее эластичными.
Эластин составляет приблизительно 50% сухого веса артерий и является результатом поперечного сшивания тропоэластина с помощью лизилоксидазы и лизилоксидазоподобного внеклеточного фермента 1-го типа. Тропоэластин синтезируется гладкомышечными клетками артерий только в раннем и подростковом возрасте. С возрастом синтез лизилоксидазоподобного внеклеточного фермента 1-го типа снижается. Производство эластина не происходит или очень ограничено у здоровых взрослых и пожилых людей.
Эластические волокна постепенно разрушаются во время старения за счет механических воздействий (усталость) и действия ферментов (например, матриксных металлопротеаз или катепсина), уровень которых повышается из-за воспаления в результате старения иммунной системы и воспалительных заболеваний.
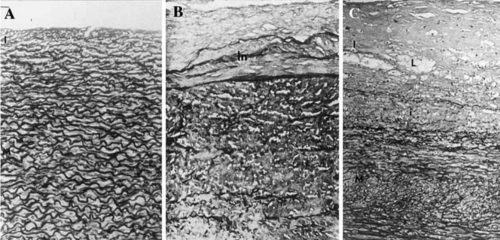
В результате старения прогрессирует фрагментация эластиновых волокон - теряется непрерывность. При старении в медианной оболочке артерии прогрессирует нарушении организации с потерей упорядоченного расположения волокон и пластин эластина. Они подвергаются истончению, расщеплению, стиранию и фрагментации.
Рисунок 33. Гистологические срезы аорты человека, показывающие возрастное разрушение эластических волокон, прогрессирующее от внутренней стороны аорты к более глубоким частям: (a) около 20 лет; (b) около 60 лет; (c) около 85 лет [pubmed.ncbi.nlm.nih.gov/18175202].
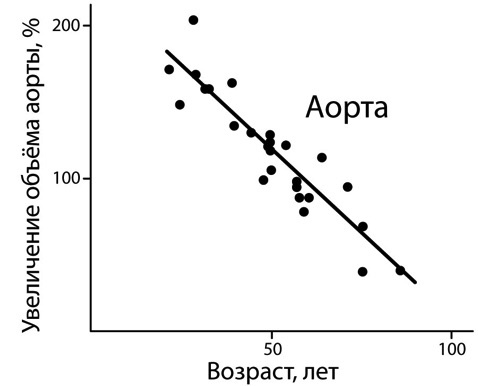 К 100 годам аорта теряет свою эластичность на столько, что наступает состояние несовместимое с жизнью [ncbi.nlm.nih.gov/pubmed/16706654].
К 100 годам аорта теряет свою эластичность на столько, что наступает состояние несовместимое с жизнью [ncbi.nlm.nih.gov/pubmed/16706654].
Рисунок 34. Возрастная потеря эластичности аорты [ncbi.nlm.nih.gov/pubmed/16706654].
Чтобы прокачать кровь через не эластичную аорту, сердце перенапрягается. Повышение систолического артериального давления увеличивает систолическую нагрузку на левый желудочек сердца, что приводит к увеличению потребления кислорода, гипертрофии левого желудочка сердца и его фиброзу. Все эти события предрасполагают к развитию возрастной сердечной недостаточности
[cyberleninka.ru/article/n/zhestkost-sosudov-i-diastolicheskaya-serdechnaya-nedostatochnost].
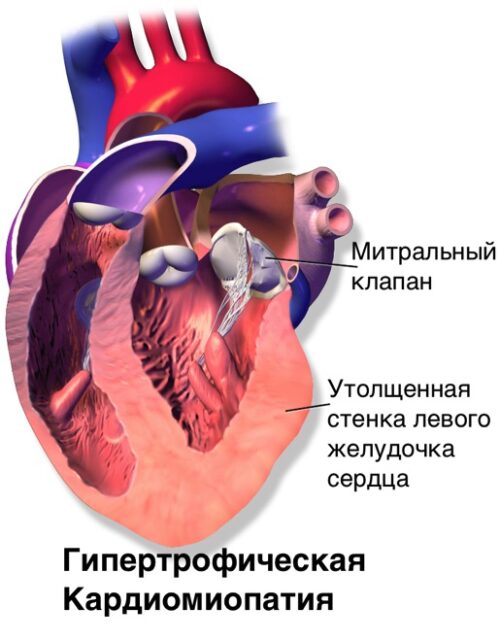 Рисунок 35. Увеличение отделов сердца при гипертрофической кардимиопатии.
Рисунок 35. Увеличение отделов сердца при гипертрофической кардимиопатии.
Читатель спросит, почему увеличение отделов сердца не фатально для молодых спортсменов. У них ведь тоже отдельные отделы сердца могут гипертрофироваться. Разница заключается в том, что сердце молодого спортсмена при гипертрофии не накапливает фиброз, а сама гипертрофия обратима. При старении сердце реагирует на нагрузку неадекватно, необратимо фиброзируется, теряя эластичность. Экспериментальные исследования показывают, что если стресс умеренный, применяется постепенно, а животное молодое и здоровое, то развивается физиологическая гипертрофия сердечной мышцы с нормальной сократительной способностью. В таком случае гипертрофию сердца можно рассматривать как полезную адаптацию к повышенной гемодинамической нагрузке. Когда провоцирующий стресс сильный, применяется внезапно, либо животное старое или ослабленное, то развивается патологическая гипертрофия. В этом случае сердечная мышца заменяется фиброзной тканью и проявляет пониженную сократительную способность [pubmed.ncbi.nlm.nih.gov/6448546]. Такие же результаты показывает гипертрофия сердечной мышцы при экспериментальной гипертензии у молодых и старых животных. У старых животных с артериальной гипертензией наблюдаются увеличение количества дистрофических и некротических клеток, а также увеличение очагов фиброза [pubmed.ncbi.nlm.nih.gov/6235863]. Эксперименты показывают, что старение препятствует восстановлению сердца после гипертрофии, препятствует восстановлению функции желудочков сердца после кардиомиопатии, вызванной изопротеренолом. После инфузии изопротеренола у пожилых мышей развивается сердечная недостаточность с гипертрофией клеток и фиброзом сердечной ткани. После отмены действия изопротеренола у молодых самок мышей наблюдается полное обращение вспять вызванной изопротеренолом сердечной недостаточности. И наоборот, обращение вспять сердечной недостаточности нарушено у пожилых животных. Не происходит восстановления фракции выброса, у старых наблюдается гипертрофия клеток сердца, сохраняется фиброз сердца. Пожилые животные, в отличие от молодых, демонстрируют нарушение обратного восстановления сердца, сохраняют фиброз сердечной мышцы, нарушение функции сердца даже после отмены действия изопротеренола [pubmed.ncbi.nlm.nih.gov/35008601]. Сшитый коллаген устойчив к деградации ферментами, значительно стабилизируя фиброз, делая его необратимым [pubmed.ncbi.nlm.nih.gov/33688918].
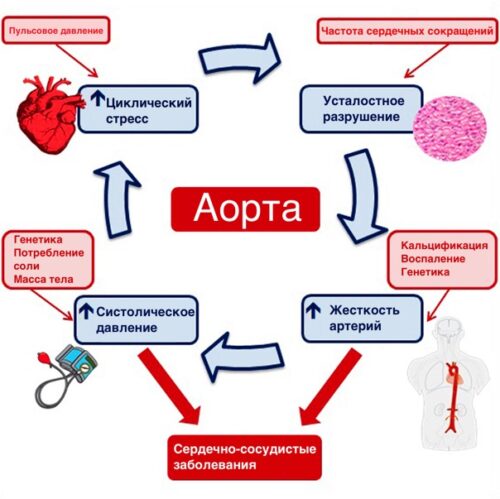 Рисунок 36. Циклический стресс, который испытывают артерии из-за регулярных сокращений сердца, является причиной усталости и разрушения эластина в аорте, так как эластин во взрослом организме не восстанавливается. Чем чаще сокращается сердце в течение жизни, тем больше циклический стресс. И это является основной причиной повышения жесткости аорты. Дополнительными причинами, ускоряющими разрушение эластина, являются воспаление и кальцификация аорты, о которых мы поговорим ниже. Жесткость аорты приводит к повышению систолического артериального давления, которое в свою очередь усиливает циклический стресс, и патологический круг замыкается [pubmed.ncbi.nlm.nih.gov/32102569].
Рисунок 36. Циклический стресс, который испытывают артерии из-за регулярных сокращений сердца, является причиной усталости и разрушения эластина в аорте, так как эластин во взрослом организме не восстанавливается. Чем чаще сокращается сердце в течение жизни, тем больше циклический стресс. И это является основной причиной повышения жесткости аорты. Дополнительными причинами, ускоряющими разрушение эластина, являются воспаление и кальцификация аорты, о которых мы поговорим ниже. Жесткость аорты приводит к повышению систолического артериального давления, которое в свою очередь усиливает циклический стресс, и патологический круг замыкается [pubmed.ncbi.nlm.nih.gov/32102569].
Из-за того, что артерии становятся более жесткими, скорость распространения пульсовой волны увеличивается, усиливается пульсирующий ток в микрососудах мозга, почек. А возрастание сопротивления, которое оказывает восходящая аорта прохождению волны кровотока, приводит в конечном итоге к сердечной недостаточности даже в отсутствии атеросклероза [pubmed.ncbi.nlm.nih.gov/20733089].
 И так, мы определили предел продолжительности жизни человека, а также определили, что именно не позволяет жить человеку немногим более ста лет. Какие еще проблемы убивают человека при старении?
И так, мы определили предел продолжительности жизни человека, а также определили, что именно не позволяет жить человеку немногим более ста лет. Какие еще проблемы убивают человека при старении?
Рисунок 37. Риск смерти от семи наиболее частых причин неслучайной смерти, что соответствует 70% всех смертей, зарегистрированных в США в 2015 г [pubmed.ncbi.nlm.nih.gov/30099284].
И так, чтобы рассчитывать на радикальное продление жизни человека, а не тех, кто является мышью, нужно восстановить эластичность тканей, вылечить сердечно-сосудистые заболевания, не допустить болезнь Альцгеймера и другие старческие заболевания мозга, предупредить, либо вылечить хроническую болезни почек, восстановить снижение функцию иммунитета.
Чтобы восстановить уровень эластичности артерий, нужно разрабатывать технологии, нацеленные на восстановление скорости синтеза нового эластина и очищения его от кальция
Сокращение калорийности питания уже почти не увеличивало максимальную продолжительность жизни долгоживущим макакам резусам, которые проживали в Национальном парке [pubmed.ncbi.nlm.nih.gov/28094793]. А исследования на людях позволяют предположить, что вся польза сокращения калорий у людей без недоедания – это способ избежать ожирения. Этим и ограничена вся его польза. Если это так, то достаточно иметь идеальную талию, и на этом все достижения биологии старения, полученные в результате изучения мышей, в основном и заканчиваются [ncbi.nlm.nih.gov/pubmed/27544442].
Если биология старения до сих пор топчется на одном и том же месте и не может превзойти эффективность низкокалорийного питания для продления жизни крыс и мышей, эффективность которого была показана еще в далеком 1935 году [ncbi.nlm.nih.gov/pubmed/2520283] [ncbi.nlm.nih.gov/pubmed/1095975], то медицина показывает неплохие успехи. Благодаря медицинским компаниям в ближайшие десятилетия ожидается целый ряд новых методов лечения заболеваний, которые и позволят радикально увеличить продолжительность жизни человека. Например, медицинские компании, которые разрабатывают методы превращения кальцинированных тканей и органов в эластичные, восстанавливая эластин, а также медицинские компании, ведущие поиск лекарств для лечения аневризмы аорты, требующие опять же восстановления утраченного эластина, который быстро разрушается при этом заболевании, что заканчивается смертью пациента без оперативного вмешательства. Если это у них получится, то ожидаемая продолжительность жизни человека может стать, как минимум 95 лет, а максимальная продолжительность жизни достигнет как минимум отметки в 125 лет.
Научные группы, которые занимаются поиском терапий восстановления эластина: Elastrin Therapeutics, RLE Group и другие. Elastrin Therapeutics Inc. (Гринвилл, Южная Каролина, США, 7 апреля 2022 г. elastrin.com), - это частная биотехнологическая компания, которая использует платформу для разработки терапевтических средств, возвращающие эластичность кальцинированным тканям и органам, восстанавливая эластин. Radical life extension group [https://rle4.life] - группа ученых, аналитиков.
 Рисунок 38. Чтобы восстановить уровень эластичности артерий, нужно разрабатывать технологии, нацеленные на восстановление скорости синтеза нового эластина и очищения его от кальция, который лишает эластин эластических свойств, вытесняя из него молекулы воды [pubmed.ncbi.nlm.nih.gov/18175202].
Рисунок 38. Чтобы восстановить уровень эластичности артерий, нужно разрабатывать технологии, нацеленные на восстановление скорости синтеза нового эластина и очищения его от кальция, который лишает эластин эластических свойств, вытесняя из него молекулы воды [pubmed.ncbi.nlm.nih.gov/18175202].
Среди перспективных методов сохранения и восстановления эластина, удаления кальция можно выделить: повышение экспрессии фибрина-5 и фибрина-4 [pubmed.ncbi.nlm.nih.gov/22702062] [pubmed.ncbi.nlm.nih.gov/31357639], блокада рецепторов DDR1 [pubmed.ncbi.nlm.nih.gov/30581820], понижение активности матриксных металлопротеиназ, локализованная доставка доксициклина в ткани аневризмы брюшной аорты в низких микромолярных дозах с помощью инфузии [pubmed.ncbi.nlm.nih.gov/27884774] [pubmed.ncbi.nlm.nih.gov/28087488], снижение уровня некарбоксилированного матричного Гла белка в организме с помощью витамина К2 (МК-7) [pubmed.ncbi.nlm.nih.gov/30581820] [pubmed.ncbi.nlm.nih.gov/28756183], а также технологии введения малых интерферирующих РНК [pubmed.ncbi.nlm.nih.gov/34586381] для нокдауна генов, кодирующих синтез матриксных металлопротеиназ.
Клетки сосудов меняются на клетки костной ткани и накапливают кальций потому, что внеклеточный матрикс сосудов становится более жестким из-за старения. Сигналы жесткости от внешней среды передаются клеткам через механорецепторы, меняя работу генов [pubmed.ncbi.nlm.nih.gov/30581820]. Повышение уровня гиалуроновой кислоты в тканях снижает их жесткость и обеспечивает большую эластичность внеклеточного матрикса [pubmed.ncbi.nlm.nih.gov/30581820].
Подробнее читайте в статье "Радикальное продление жизни — часть 6. Омоложение артерий и сердца"
Введение интерлейкина 7-го типа и фактора роста кератиноцитов, трансплантация эпителиальных клеток тимуса, использование внеклеточной матрицы в качестве каркаса для клеток с целью регенерации тимуса, излечение аутоиммунных заболеваний с помощью анти-CD19 CAR-T-клеточной терапии, а также пересадка костного мозга - перспективные методы омоложения иммунной системы
На рисунке 37 показано, что грипп и пневмония - одна из ведущих причин смертности в позднем возраста из-за старения иммунной системы. Сниженная функция иммунитета также является одной из причин повышения риска онкологических заболеваний у пожилых людей. В 2010 году Тюбингенская группа иммунологии старения и опухолей опубликовала статью о том, что возрастные изменения иммунитета могут также способствовать возрастному росту заболеваемости большинством видов рака, ухудшая способность иммунных клеток распознавать и уничтожать раковые клетки [ncbi.nlm.nih.gov/pubmed/20656212].
С возрастом снижается количество иммунных наивных Т-клеток и разнообразие их рецепторов, необходимых для эффективной реакции на незнакомые вирусы; снижается эффективность отбраковывания аутореактивных Т-лимфоцитов иммунной системы, способных вызывать хроническое воспаление и аутоиммунные заболевания. Все иммунные клетки организма формируются в костном мозге от гемопоэтических стволовых клеток, которые могут оставаться молодыми, но стареют под воздействием стареющей стволовой ниши, что также сопровождается старением клеток врожденного и адаптивного иммунитета.
Введение интерлейкина 7-го типа [pubmed.ncbi.nlm.nih.gov/26416281] [ncbi.nlm.nih.gov/pubmed/17378748] [pubmed.ncbi.nlm.nih.gov/16148161] и фактора роста кератиноцитов [ncbi.nlm.nih.gov/pubmed/17138819], трансплантация эпителиальных клеток тимуса [pubmed.ncbi.nlm.nih.gov/25870244], использование внеклеточной матрицы в качестве каркаса для клеток с целью регенерации тимуса [pubmed.ncbi.nlm.nih.gov/34306981], излечение аутоиммунных заболеваний с помощью анти-CD19 CAR-T-клеточной терапии [pubmed.ncbi.nlm.nih.gov/36109639], а также пересадка костного мозга - перспективные методы омоложения иммунной системы.
Подробнее читайте в статье: "Радикальное продление жизни — часть 4. Как восстановить или омолодить иммунитет"
Компьютерная томография ткани тимуса показала, что замена функциональной ткани тимуса на жировую положительно коррелирует с повышенным индексом массы тела вследствие ожирения и с курением [pubmed.ncbi.nlm.nih.gov/25925358]. С другой стороны, у пожилых людей, которые большую часть своей взрослой жизни занимались ездой на велосипеде, по сравнению с их менее активными коллегами, наблюдалось снижение возрастной потери функции тимуса, большее количество наивных Т-клеток иммунитета, увеличение доли регуляторных B-клеток, важных для предотвращения аутоиммунных атак собственных тканей организма, снижение маркеров воспаления, повышение уровня интерлейкина 7 и 15-го типов в сыворотке крови, что может способствовать сохранению функции тимуса с возрастом [pubmed.ncbi.nlm.nih.gov/29517845] [pubmed.ncbi.nlm.nih.gov/31175337]. Вывод: чтобы не ускорять старение иммунитета, нужно регулярно заниматься аэробными физическими упражнениями (бег, плавание, езда на велосипеде и т.п.) и избегать набора лишней жировой массы тела, а также и ее дефицита.
4-5 ежемесячных циклов голоданий по 4 дня подряд могут увеличивать долю наивных Т-клеток иммунитета у людей, что связано с ростом вероятности, что при проникновении в организм какого-либо нового вируса найдётся Т-клетка, рецепторы которой окажутся подходящими для того, чтобы его обезвредить.
Потенциальные средства, которые имеют шансы на омоложение, либо замедление прогрессирования заболевания почек в будущем: эверолимус, ингибиторы натрий-глюкозного транспортера 2-го типа, трансплантация поджелудочной железы, подавление фактора ингибирования миграции макрофагов, ингибирование активатора плазминогена 1-го типа, пирфенидон
Риск заболеть и умереть от хронической почечной недостаточности растет с возрастом из-за старения. Хроническая болезнь почек является одной из самых быстрорастущих причин смертности во всем мире, и ожидается, что к 2040 году она станет пятой по распространенности причиной смерти во всем мире, а к концу столетия - второй по значимости причиной смерти в странах с высокой ожидаемой продолжительностью жизни [pubmed.ncbi.nlm.nih.gov/30340847] [pubmed.ncbi.nlm.nih.gov/30503082].
Потенциальные средства, которые имеют шансы на омоложение, либо замедление прогрессирования заболевания почек в будущем: эверолимус 5 мг/нед [pubmed.ncbi.nlm.nih.gov/19667948] [pubmed.ncbi.nlm.nih.gov/25540326], ингибиторы натрий-глюкозного транспортера 2-го типа [pubmed.ncbi.nlm.nih.gov/32060481], трансплантацию поджелудочной железы [pubmed.ncbi.nlm.nih.gov/9654536], подавление фактора ингибирования миграции макрофагов [pubmed.ncbi.nlm.nih.gov/28801314], ингибирование активатора плазминогена 1-го типа [pubmed.ncbi.nlm.nih.gov/31071225], пирфенидон 1200 мг/сутки [clinicaltrials.gov/ct2/show/NCT04258397] [pubmed.ncbi.nlm.nih.gov/34999158] [ajkd.org/article/S0272-6386(21)01051-9/pdf].
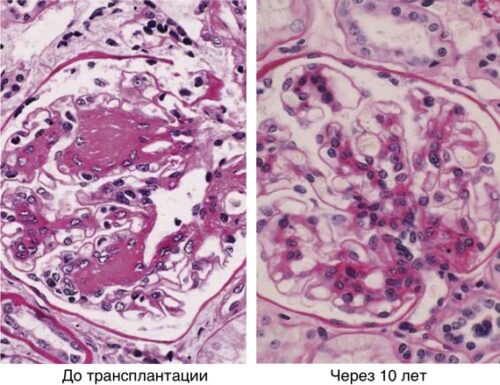 Трансплантация поджелудочной железы обращала вспять фиброз почек. Обращение фиброза почек вспять у людей достижимо, но сроки должны измеряться десятилетиями, по крайней мере, когда метод лечения ограничивается удалением стимула фиброза [pubmed.ncbi.nlm.nih.gov/9654536].
Трансплантация поджелудочной железы обращала вспять фиброз почек. Обращение фиброза почек вспять у людей достижимо, но сроки должны измеряться десятилетиями, по крайней мере, когда метод лечения ограничивается удалением стимула фиброза [pubmed.ncbi.nlm.nih.gov/9654536].
Рисунок 39. Через 10 лет после трансплантации поджелудочной железы в клубочке почки заметно рассасывание диффузных и узловых мезангиальных поражений, а также более открытый просвет клубочковых капилляров.
Подробнее читайте в статье: "Радикальное продление жизни — часть 5. Как омолодить почки".
Риск заболеть и умереть от хронической почечной недостаточности растет с возрастом. Скорость клубочковой фильтрации (СКФ) является одной из важнейших характеристик функции почек. Она показывает, какое количество жидкости проходит за единицу времени через структурно-функциональные единицы почек, объем образования мочи за единицу времени. Если ваша скорость клубочковой фильтрации почек < 60 мл/мин/1,73 м2, то по возможности, устраните факторы, способствующие ухудшению работы почек, и измените свой образ жизни:
- Низкобелковая диета (но не ниже, чем 1 г белка на 1 кг веса тела в сутки) с низким содержанием соли (≤ 6 г/сут) может привести к более медленному прогрессированию хронической болезни почек [pubmed.ncbi.nlm.nih.gov/29091561].
- Диета с низкой гликемической нагрузкой [ncbi.nlm.nih.gov/pubmed/25638596] [ncbi.nlm.nih.gov/pubmed/25250626]. Определить гликемическую нагрузку рациона питания можно с помощью глюкометра. Для этого нужно измерить уровень глюкозы в крови глюкометром через 50 минут после окончания прима пищи. Уровень глюкозы должен быть не более 6,8 ммоль/л [pubmed.ncbi.nlm.nih.gov/30545323]. Основу питания должны составлять овощи, фрукты, цельнозерновые злаки, бобовые, орехи, рыба и птица с исключением сладостей и сладких напитков [pubmed.ncbi.nlm.nih.gov/9989963] [pubmed.ncbi.nlm.nih.gov/24222015] [pubmed.ncbi.nlm.nih.gov/29897866].
- Для снижения темпов прогрессирования снижения СКФ с возрастом целесообразно: выполнять минимум 1 раз в год обследование с определением СКФ и уровня альбуминурии/протеинурии в моче.
- Избегать курения [pubmed.ncbi.nlm.nih.gov/11033585].
- Избегать избыточной массы тела >25 кг/м2 за счет коррекции калорийности рациона питания и достаточной физической активности [pubmed.ncbi.nlm.nih.gov/17091123].
- Ограничить потребления алкоголя [pubmed.ncbi.nlm.nih.gov/21251296].
- Избегать бесконтрольного приема анальгетиков, антибиотиков, пищевых добавок [pubmed.ncbi.nlm.nih.gov/21251296], в том числе пищевых добавок для сжигания жира и наращивания мышечной массы.
- Контролировать уровень артериального давления (АД) - избегать как высоких, так и низких уровней АД (целевой уровень систолического АД <139 мм рт. с.) [pubmed.ncbi.nlm.nih.gov/12965979].
- Избегать снижения уровня гемоглобина в крови ниже 120 г/л для женщин и 130 г/л для мужчин [pubmed.ncbi.nlm.nih.gov/15593047].
- Избегать повышенного уровня мочевой кислоты в крови (более 350 мкмоль/л), повышенного уровня холестерина, дефицита (ниже 20 нг/мл) или избытка (выше 56 нг/мл) витамина D в крови [nestarenie.ru/vitamin-d3.html]
- Избегать недостатка молочных продуктов в питании [nestarenie.ru/moloka.html], избытка таблетированных добавок кальция [pubmed.ncbi.nlm.nih.gov/26977089].
Перспективными методами омоложения мозга являются восстановление функции микроглии и технология снижения жесткости внеклеточного матрикса головного мозга
Болезнь Альцгеймера – неизлечимое возрастное заболевание головного мозга, которое приводит к нарушению памяти, речи, способности ориентироваться в обстановке и ухаживать за собой, а в итоге к смерти.
До сих пор преобладала теория, что причина болезни Альцгеймера - накопление амилоидных отложений (АО). Все клинические исследования, направленные на удаление АО, закончились неудачей. У большинства людей нейрофибриллярная дегенерация (НД) первоначально развивается десятки лет в отсутствие АО. Это не согласуется с гипотезой накопления АО, потому что как АО могут быть причиной НД, если их нет при возникновении НД, а в некоторых случаях болезни Альцгеймера АО вообще не выявляются. А индуцированные АО не запускают НД. Основываясь на том факте, что у всех 100% исследуемых образцов мозга встречалась нейрофибриллярная дегенерация, а АО - только у 35%, и только в 8% случаях выявлено нейровоспаление, был сделан вывод о том, что последовательность развития патологического поражения мозга на пути к болезни Альцгеймера начинается с нейрофибриллярной дегенерации, за которой следует накопление АО, а уже только потом следует нейровоспаление. Одним из очевидных следствий из этих наблюдений является то, что нейрофибриллярная дегенерация возникают в отсутствие нейровоспаления и накопления АО, что противоречит гипотезе АО, как причине болезни Альцгеймера. Наиболее убедительная гипотеза потери умственных способностей с возрастом - это снижения нейропластичности, возможно из-за или также из-за утраты функции микроглии. Указанная выше информация представлена в работе Wolfgang J Streit и Habibeh Khoshbouei из Университета Флориды, США, а также Ingo Bechmann из Анатомического института Лейпцигского университета, Германия [pubmed.ncbi.nlm.nih.gov/33361603].
 Рисунок 40. Клетки нервной ткани мозга. Микроглия представляет клетки иммунитета. Нейроны - главные клетки мозга, благодаря которым мы думаем, помним и т.д. Нейроны сообщаются с другими нейронами через специализированные соединения, называемые синапсами. Дендрит - разветвлённый отросток нейрона, который получает информацию через химические (или электрические) синапсы от аксонов (или дендритов и сомы) других нейронов и передаёт её через электрический сигнал телу нейрона, из которого вырастает.
Рисунок 40. Клетки нервной ткани мозга. Микроглия представляет клетки иммунитета. Нейроны - главные клетки мозга, благодаря которым мы думаем, помним и т.д. Нейроны сообщаются с другими нейронами через специализированные соединения, называемые синапсами. Дендрит - разветвлённый отросток нейрона, который получает информацию через химические (или электрические) синапсы от аксонов (или дендритов и сомы) других нейронов и передаёт её через электрический сигнал телу нейрона, из которого вырастает.
Опираясь на вышесказанное, перспективными методами омоложения мозга являются восстановление функции микроглии и технология снижения жесткости внеклеточного матрикса головного мозга, например, с помощью прямой инъекции в мозг фермента хондроитиназы [pubmed.ncbi.nlm.nih.gov/24974208] [pubmed.ncbi.nlm.nih.gov/32865286].
Подробнее читайте в статье: "Радикальное продление жизни — часть 3. Как защитить мозг от старения".
Продолжительность жизни пациентов с деменцией (слабоумие с утратой самостоятельности) в среднем 6-10 лет, в ряде случаев всего 2 года. Итак, если риск болезни Альцгеймера можно снизить, то что именно нужно делать для этого? Вот программа снижения риска болезни Альцгеймера в будущем. Данная программа также позволяет восстановить утраченные умственные способности, когда еще нет заболевания, но почему-то вы замечаете, что стали соображать и помнить хуже, чем раньше.
- В результате систематического недостатка сна возникает дефицит внимания и рабочей памяти [ncbi.nlm.nih.gov/pubmed/19300585] [ncbi.nlm.nih.gov/pubmed/15124713] [ncbi.nlm.nih.gov/pubmed/30670158]. При устранении дефицита сна рабочая память восстанавливается через 2 недели. Необходимо спать для большинства людей не менее 7 часов в сутки [ncbi.nlm.nih.gov/pubmed/19300585].
- Упражнения для тренировки памяти и других умственных способностей [pubmed.ncbi.nlm.nih.gov/27838936].
- Регулярные аэробные физические упражнения в течение 6-12 месяцев [ncbi.nlm.nih.gov/pubmed/30700591] [ncbi.nlm.nih.gov/pubmed/26316729] и/или питание с низкой гликемической нагрузкой могут снижать темпы ухудшения умственных способностей с возрастом [ncbi.nlm.nih.gov/pubmed/25149688]. Необходимо заниматься умеренной аэробной физической нагрузкой (бег, скандинавская ходьба и др.) минимум 150 минут в неделю [ncbi.nlm.nih.gov/pubmed/30700591], либо физической активностью, которой позволяют заниматься ваши способности и условия.
- Питание с низкой гликемической нагрузкой, богатое овощами [ncbi.nlm.nih.gov/pubmed/25034880].
- Стеноз сонных артерий ухудшает умственные способности [ncbi.nlm.nih.gov/pubmed/21700413]. Следите за состоянием толщины КИМ сонных артерий, чтобы предупредить стеноз. Вот мотивирующий пример, как этого добиться. Программа уменьшения толщины КИМ сонных артерий. Если уже сформировался стеноз сонных артерий, то необходимо рассмотреть целесообразность каротидной эндартерэктомии (вид хирургического вмешательства, который подразумевает чистку или расширение сонной артерии), либо стентирование (установка стента, который помещается в просвет сосудов и обеспечивает расширение участка, суженного стенозом). Проспективные исследования пациентов с бессимптомным стенозом сонных артерий ≥ 70%, перенесших стентирование или каротидную эндартерэктомию показало, что после вмешательства у пациентов были улучшены оценки в целом ряде когнитивных тестов [pubmed.ncbi.nlm.nih.gov/21700413] [pubmed.ncbi.nlm.nih.gov/24726144].
- Кофеин помогает сохранять бдительность после лишения сна [pubmed.ncbi.nlm.nih.gov/10947033] [pubmed.ncbi.nlm.nih.gov/12424548] [pubmed.ncbi.nlm.nih.gov/15887055].
- Даже легкий дефицит железа независимо связан с более плохими результатами в когнитивных тестах [ncbi.nlm.nih.gov/pubmed/18382689]. А компенсация железа улучшает внимание и память у пациентов с уровнем ферритина в крови ниже 15 мкг/л и гемоглобин ниже 120 г/л [ncbi.nlm.nih.gov/pubmed/28954841] [ncbi.nlm.nih.gov/pubmed/24379009]. Эффект компенсации дефицита железа на умственные способности ожидается через 4 месяца.
- Потребление молочного белка в течение 4,5 месяцев улучшает результаты тестирования на умственные способности [pubmed.ncbi.nlm.nih.gov/29905824].
- Даже легкий дефицит витамина В12 (<200 пг/мл для людей младше 50 лет и <500 пг/мл для людей от 50 лет и старше) может сопровождаться легким нарушением умственных способностей, а терапия витамином B12 в течение 3-12 месяцев связана с улучшением [ncbi.nlm.nih.gov/pubmed/32206454].
- Отказаться от курения [pubmed.ncbi.nlm.nih.gov/24962204].
- Избегать ожирения [pubmed.ncbi.nlm.nih.gov/27890688]. Оптимальная окружность талии составляет не более 89 см для мужчин и не более 69 см для женщин.
- Правильно и своевременно лечить повышенное артериальное давление [pubmed.ncbi.nlm.nih.gov/30688979] [pubmed.ncbi.nlm.nih.gov/24196416].
- Контролировать гликемию при сахарном диабете [pubmed.ncbi.nlm.nih.gov/31219687]
- Не злоупотреблять алкоголем [pubmed.ncbi.nlm.nih.gov/28097521].
- Повышенный уровень D-димера связан с повышенным риском развития деменции. Болезнь Альцгеймера сопровождается локальными нарушениями процесса растворения тромбов и сгустков крови, которые, как полагают, связаны с накоплением АО (амилоидных отложений) в фибриновых сгустках, что препятствует связыванию плазминогена [pubmed.ncbi.nlm.nih.gov/33539904]. Оптимальное значение D-димера (за исключением беременных женщин):< 442 нг/мл FEU, где FEU - это Fibrinogen-Equivalent Unit или < 221 нг/мл DDU, где DDU - это D-Dimer Unit. Для лиц старше 50 лет [pubmed.ncbi.nlm.nih.gov/22072293] [pubmed.ncbi.nlm.nih.gov/20354012], специфичность оценок может быть повышена использованием корректированного возрастного порога, который можно рассчитать, как (ВОЗРАСТ) * 5, для DDU - это D-Dimer Unit или (ВОЗРАСТ) * 10, для FEU - это Fibrinogen-Equivalent Unit. Например, для человека 60 лет = 60*5 = 300. То есть < 300 нг/мл DDU
FDA и FTC предупредили производителей и потребителей о возможном рекламном мошенничестве в отношении ноотропных добавок [ftc.gov/news-events/press-releases/2019/02/ftc-fda-send-warning-letters-companies-selling-dietary] [fda.gov/consumers/health-fraud-scams/unproven-alzheimers-disease-products]. Лекарства и добавки, которые широко используются многими нейрохакерами для оптимизации мозга, часто также не имеют доказательств эффективности и даже могут быть опасны для здоровья.
Заключение:
Ключ к радикальному продлению жизни лежит не в исследованиях биологов, которые исследуют животных, а в разработках медицинских компаний, так как они занимаются исследованием человека. Биотехнологические медицинские компании ищут лекарства для лечения смертельных болезней. А как же иначе? Ведь именно эти болезни и сокращают жизнь человеку, а не мышам или мухам. Давайте еще раз кратко их перечислим.
Аневризма аорты. Это заболевание, которое сопровождается ускоренным разрушением эластина, и в итоге - смертью от разрыва аорты и кровотечения. Лечение аневризмы аорты - ключ к восстановлению эластина человека. Восстановлением эластина занимаются компании:
- Биоинженеры из США (на базе клиники Кливленда).
- Гринвилл, Южная Каролина, США, 7 апреля 2022 г. – Elastrin Therapeutics Inc., частная биотехнологическая компания.
- RLE group, Россия. https://rle4.life
Кальцификация аортального клапана и кальциноз стенок сосудов. Если на рынке появится лекарство для лечения кальциноза, то будет решена проблема отложения кальция в эластине, который лишает эластин его эластических свойств.
Склероз сосудов и атеросклероз, возникающий из-за нарушения липидного обмена. Решением этой задачи занимается Marianne Benn, Anne Tybjærg-Hansen, Børge G Nordestgaard (Копенгагенский университет, Дания).
Болезнь Альцгеймера. Для лечения этого заболевания необходимо решить проблему восстановление утраченной функции микроглии, а также размягчения внеклеточного матрикса мозга. Сегодня этим занимаются организации:
- Center for Neurogenomics and Cognitive Research, Neuroscience Campus Amsterdam, Amsterdam, Netherlands.
- Немецкая группа ученых из немецкого центра нейродегенеративных заболеваний и института воспаления и нейродегенерации.
Фиброз почек и энволюция тимуса.
С января 2023 года проект Nestarenie будет собирать научные группы на различные проекты. Задача претворить озвученные здесь методы радикального продления жизни в жизнь. Пишите мне на WhatsApp +7 925 924 43 28
Выводы:
- Прорыв в различных научных сферах, в том числе и в биологии, происходит после смены поколений, когда более старое поколение своей уверенностью в невозможности чего-либо, больше не тормозит научный прогресс
- Математически старение — это процесс, приводящий к росту вероятности заболеть в каждый момент времени с возрастом, а позже к росту вероятности умереть в каждый момент времени с возрастом. То есть старение - это ускорение смертности, а не внешние изменения
- Сегодня ни одной исследовательской группе, ни разу не удавалось воспроизводимо замедлить скорость старения нормальных, а не коротко живущих мышей
- Мало вероятно, что комбинации методов, увеличивавших продолжительность жизни в экспериментах на мышах, смогут увеличить максимальную продолжительность жизни (МПЖ) человека, так как большинство этих комбинаций уже работают при сокращении калорийности рациона у мышей. А людям сокращение калорийности рациона дает эффект, аналогичный отсутствию ожирения, что не влияет на МПЖ человека, а лишь может улучшить здоровье
- Пора переходить от исследований биологии старения мышей к исследованиям биологии старения человека. Люди потому и живут долго, что большинство известных проблем, ограничивающих жизнь коротко живущих животных, биология человека уже решила
- Долгоживущие животные, проживающие в оптимальных условиях, вероятно, уже исчерпали ресурс продления жизни за счет снижения базовой уязвимости. Это относится и к человеку, который живет в условиях хорошей гигиены, безопасности и имеет медицинское обслуживание
- Если ученый будет упираться в публикацию научной статьи с новой прорывной теорией, ему придется работать над одной статьей многие годы. Это не способствует росту его карьеры. В результате огромное количество статей приводит не к смене центральных идей в науке, а скорее к окостенению канона и отсутствию научного прогресса
- На физическом уровне старение - это постепенное нарастание жесткости, потеря эластичности тканей, окружающих клетки организма
- Когда мы понимаем, в каком возрасте находится предел продолжительности жизни человека, то это позволяет точнее понять, что именно людям не позволяет жить дольше
- Приблизительный верхний предел продолжительности жизни человека ограничивается на отметке 100-120 лет эластичными свойствами сердца, артерий, и системы дыхания
- Чтобы восстановить уровень эластичности артерий, нужно разрабатывать технологии, нацеленные на восстановление скорости синтеза нового эластина и очищения его от кальция
- Введение интерлейкина 7-го типа и фактора роста кератиноцитов, трансплантация эпителиальных клеток тимуса, использование внеклеточной матрицы в качестве каркаса для клеток с целью регенерации тимуса, излечение аутоиммунных заболеваний с помощью анти-CD19 CAR-T-клеточной терапии, а также пересадка костного мозга - перспективные методы омоложения иммунной системы
- Потенциальные средства, которые имеют шансы на омоложение, либо замедление прогрессирования заболевания почек в будущем: эверолимус, ингибиторы натрий-глюкозного транспортера 2-го типа, трансплантация поджелудочной железы, подавление фактора ингибирования миграции макрофагов, ингибирование активатора плазминогена 1-го типа, пирфенидон
- Перспективными методами омоложения мозга являются восстановление функции микроглии и технология снижения жесткости внеклеточного матрикса головного мозга
-
Знаете ли вы, что сайт nestarenie.ru — объективно один из самых популярных в России ресурсов про старение и долголетие - в Яндексе, в Гугле, по количеству, качеству и лояльности аудитории. nestarenie.ru имеет потенциал, чтобы стать одним из самых популярных сайтов о борьбе со старением не только в России, но и в мире. Для этого нужны деньги. Я призываю всех сделать пожертвования, а также убедить своих друзей поступить аналогично. Карта МИР в Сбере (рубли): 2202 2032 1501 6686 (МАЙЯВИ Ч.)
Обязательно оставляйте свои комментарии под статьей, которую Вы читаете. Это очень важно для нас.
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить. Обязательно оставляйте свои комментарии под статьей, которую вычитаете. Это очень важно для нас.

Автор статьи
Веремеенко Дмитрий Евгеньевич
Телефон:
Почта:
Сфера деятельности - data science в медицине
Основатель проекта, изучающего терапии, направленные на увеличение продолжительности жизни человека (nestarenie.ru/slb-expert_.html)
Со-основатель IT сервиса продления жизни
Основатель форума о продлении жизни Nestarenie Camp (nestarenie.ru/camp.html)
Со-автор книги "Бонусные годы" (nestarenie.ru/kniga-3.html)
Создатель справочного блога о старении человека (nestarenie.ru)
Социальные сети:
- Карта Viza (доллары): 4215 8901 1587 0138 для переводов за пределами РФ
- Карта МИР в Сбере (рубли): 2202 2032 1501 6686 (МАЙЯВИ Ч.) - на территории РФ
42 комментария
-
Максим (58-й-183см-70кг-талия 78см)10 января 2023, 06:58
Дмитрий писал: …”Если бы Бернард Да́нциг знал, что эти задачи невозможно решить, то он никогда бы этого не сделал, как он сам признавался. … И вот вам сегодня многие известные профессора говорят, что старение нельзя победить. Это самое плохое, что они могут для Вас сделать. Так как после таких слов, Вы даже не попытаетесь это сделать”.
Вот так и надо действовать. Хороший пример именно индивидуального подхода.
-
Зиновий Белкин08 января 2023, 10:22
1. Как могут механические сигналы, даже воздействуя на актин и миозин, актин , растягивать хромосомы ?
2. Все теории старения делятся на:
А. Теории накопления повреждений.
Б. Программа старения (часы)
Возможно, что именно часы, в частности, через ослабление с возрастом системы репарации, и в том числе таким образом через фиброз (Новый вариант теории И. Мечникова) влиять на старение клеток. И прежде всего гипоталамуса. -
Зиновий08 января 2023, 08:54
Вы приводите работу, в которой показано, что
«Фиброз лёгких у старых мышей необратим в отличие от молодых».
Значит, системы репарации межклеточной ткани работают все
хуже с возрастом.
Поэтому и стареет матрикс с возрастом.
(Кстати, интересно, если перенести матрикс от старой мыши молодой, может ли он «рассосаться» ?).
Итак, можно себе представить, что удаление всего старого (клетки, митохондрии и другие органелла, да и сама цитоплазма, а также межклеточный матрикс) , вот эта функция слабеет с возрастом благодаря работе
Центральных Биологических Часов…, а старение матрикса есть следствие ослабления работы систем ремонта, т.е. вторично.
И тогда надо заниматься в первую голову поиском первопричины старения. -
Зиновий07 января 2023, 12:46
Каким образом сигналы жесткости вызывают
ПОСЛЕДОВАТЕЛЬНОЕ изменение экспрессии
генов при старении?
Изучали ли изменение жесткости внеклеточного матрикса гипоталамуса на его старение?
А у голых землекопов изучали фиброз?
Согласно вашей теории часы старения принципиально отличаются от часов развития организма? -
Галина03 декабря 2022, 12:13
Согласна с Павлом Елисеевым. Мне 66 лет и я четки вижу взаимосвязь кишечника и головы.
Например, если с кишечником что-то не так – всегда начинает болеть голова.
При этом давление немного повышается.
Однако никакие таблетки от давления не помогают убрать головную боль кроме так Мигрениум или поход в туалет по большому.
При таких ценах на продукты многие, в том числе и я, налегают на мучное, включая хлеб. Хлеб пеку сама на “мокрых” дрожжах.
Однако все равно именно он, наравне с перловкой и гречкой, остается главным продуктом в питании большинства людей из-за тотальной нищеты особенно в последние годы… Так что все исследования – это просто супер! Но, однако, пока мы в своей стране будем получать пенсии в 10 – 20 тысяч руб. ни о каком долгожительстве думать не приходится… -
Павел Елисеев28 ноября 2022, 16:11
Дмитрий, вы не упомянули о связи микробиоты кишечника и воспалительных процессов в организме, а там прямая связь с Альцгеймером и Паркинсоном.
-
Борис26 ноября 2022, 21:32
Вопрос скорее философский- а на кой черт человеку жить больше 100 лет? К 100 годам любые полезные для социума функции человек уже выполнил и для социума никакой практической ценности не имеет.. Чаще всего в овощном состоянии, или где-то рядом. Проблем родственникам создает при этом выше крыши. Передположим, наука предложит средства для омоложения кровеносной системы. Ну, в социуме увеличится количество возрастных “овощей” и какой-то пользы для человечества в этом не видно.
С моей т.з. надо пересмотреть отношение к смерти, как к какому-то отрицательному фактору. Для этого стоит понять, что весь негатив смерти связан исключительно со страданиями человека. При этом весьма велика вероятность, что человек обладает бессмертной душой, для которой смерть оказывается благом в большинстве случаев.
Продление жизни- это интересный научный эксперимент. Но усилия медицины должны быть направлены в большей степени от избавления человека от ужасных страданий перед смертью . Вот это и будет настоящим гуманизмом.
Но с другой стороны, попытки увеличить срок жизни человека ведут к новым методам лечения тяжелых заболеваний. Т.ч. практический смысл изучать эту проблему во всех аспектах несомненно есть. Спасибо, всей команде и лично Дмитрию.-
Максим (57лет-183см-70кг-талия 78см)27 ноября 2022, 14:55
Борис написал: 26.11.2022 в 21:32
“Вопрос скорее философский- а на кой черт человеку жить больше 100 лет? …”Меня привлекает событийная сторона долгожительства, а не философия.
Основная игра у меня начнется, с 65+, например, мне к этому моменту некая организация – “ПФР” пять лет пенсии задолжает и я желаю получить свое и с процентами. Это самое мелкое из моих планов. Основные мои цели и задачи лежат вне пределов этой локации ( нашего мира), меня очень привлекают миры космических цивилизаций! Поэтому я не планирую (в ближайшие лет 50) переходить в “овощное состояние”!Да, и еще! Дмитрий писал, что он исследователь.
А я коллекционер – я газеты с некрологами собираю! -
Сергей28 ноября 2022, 19:34
“Вопрос скорее философский- а на кой черт человеку жить больше 100 лет? ” – ваш “философский вопрос” легко превращается в еще более философский – “а на кой черт человеку жить больше 50 лет?” – остановить деление можете там, где вам больше нравится..
В общем, это длинное предложение можно заменить на короткое: ваши слова не имеют смысла, ни философского, ни житейского ))
-
-
Максим (57лет-183см-70кг-талия 78см)15 ноября 2022, 07:33
Дмитрий писал: Оптимальное значение D-димера (за исключением беременных женщин):< 442 нг/мл FEU, где FEU – это Fibrinogen-Equivalent Unit или < 221 нг/мл DDU, где DDU – это D-Dimer Unit.
А низкий Д-диммер не вредно? Посмотрел свою динамику за этот год самый большой уровень у меня был был 32,0 (рефренс 0-243) нг\мл. В остальных случаях менее 21 нг\мл (предел анализатора).
-
Vale15 ноября 2022, 02:07
В общем, вся надежда на американские биотех-компании. Реально только они все определяют. Ибо там и лаборатории супер-современные, и финансирование на миллиарды, и максимальная концентрация ученых, и максимальная коммерческая мотивация (быстрый вывод на рынок, коммерческая отдача). Т.е. там идет реальный поиск в лабораториях., и сразу же испытания в клиниках, а не теоретическое фантазирование.
Вероятнее всего, прорыв случится, когда появится очередной Эйнштейн, трудящийся в американской биотех-компании… А если точнее – очередной Илон Маск (в области биотеха)… Нам остается лишь ждать, надеяться и зОжить:)
С одной стороны, грустно (мы всего лишь “аналитики футбола, а не игроки, подобно Месси”), а с другой стороны, мы в целом ближе к решению этих проблем, нежели люди, жившие 50-100-200 лет назад… Если по аналогии с полетами в космос: Циолковский мечтал и теоретизировал, Королев сделал первые прорывные шаги, ну а Илон Маск поставил полеты в космос на поток…
Видимо, в области продления жизни мы пока на уровне Циолковского… Но это уже неплохо… До “Илона Маска” остается всего 100 лет… Доживем? -
Елена14 ноября 2022, 21:52
Дмитрий, горжусь вами!
-
Владимир13 ноября 2022, 10:07
Об этом что можете сказать? umstrana(точка)ru/article/my-vylechim-vas-ot-stareniya/
Раз вероятность смерти у человека удваивается каждые восемь лет, мы хотели найти образцы крови, которые люди сдавали бы несколько раз с интервалом примерно в восемь лет на протяжении жизни. И такой биобанк удалось найти в Англии – там несколько сотен человек порядка пятнадцати лет сдавали кровь, и она сохранилась.А потом в США сделали протеомику – провели анализ, как менялась концентрация в их крови белков – порядка 1200 белков у каждого человека – как эти белки менялись с течением времени, и в результате получили выгрузку и проанализировали с помощью нашей математической модели.
В сухом остатке мы получили список мишеней, которые нам нужно добавлять или убирать из плазмы крови для того, чтобы получить желаемый эффект, а именно уменьшить биовозраст, «отмотать» его, как вы говорите, назад, как магнитофонную плёнку.
И об этом. Тут тоже по крови работа. lenta(точка)ru/news/2020/06/16/aging/
Открыт новый способ омолодить организм и продлить жизнь
aging-us(точка)com/article/103418/text
американцы решили делать плазмоферез и половину плазмы заменять физраствором с альбумином. -
Владимир13 ноября 2022, 09:48
Не работает?
-
Максим (57лет-183см-70кг-талия 78см)11 ноября 2022, 14:39
Было написано: “Для лечения этого заболевания необходимо решить проблему восстановление утраченной функции микроглии”
Оказалось, что липидные молекулы фосфатидилсерина (фосфолипида клеточной мембраны) выставляются на мембрану поврежденных клеток и «помечают» их. Фосфатидилсерин на поверхности клеток является сигналом для их поглощения макрофагами и клетками микроглии [5].
V.E. Kagan, Y.Y. Tyurina, W.Y. Sun, I.I. Vlasova, H. Dar, et. al.. (2020). Redox phospholipidomics of enzymatically generated oxygenated phospholipids as specific signals of programmed cell death. Free Radical Biology and Medicine. 147, 231-241
//biomolecula.ru/articles/iz-lipidov-v-dirizhery-kletochnykh-reaktsii-ili-kak-obshchaiutsia-kletki#source-5
Купил, попробую! Jarrow Formulas Фосфатидилсерин !
-
Максим (57лет-183см-70кг-талия 78см)15 ноября 2022, 07:11
С сегодня приступил к профилактике и улучшению функции микроглии при помощи Jarrow Formulas PS-100 Фосфатидилсерин.
По результатам отпишусь!
-
-
Жар09 ноября 2022, 10:41
Убыль с возрастом стволовых клеток ограничивает МПЖ вида, нужно замерить их количество в крови мышей на разных этапах жизни, от детства до старости и составить график, тоже самое сделать в отношении голых землекопов и людей. А ещё изучить глаза полярной акулы, она зрячей остается до 500 лет, а вот что греландский кит после 100 лет слепнет, что человек.
-
Максим (57лет-183см-70кг-талия 78см)09 ноября 2022, 06:35
Статья отличная, двух мнений быть не может.
Однако, лозунг “Спасение утопающих дело рук самих утопающих” актуален как никогда.
Читал я статью и крутил велотренажер, 20 км за час накрутил. -
Адам+Палюхович08 ноября 2022, 21:52
Спасибо, статья достойная, под стать соответствующему видеоматериалу.
И всё-таки, чёйто пока не видно естественных, да и фармокологических средств, увеличивающих эластичность внеклеточного матрикса и, соответственно, омолаживающих человека.
На основании своего (и не только) опыта, предложу-таки “кандидатов” из когорты естественных средств и методов:
– Голодание водное разной продолжительности.
– Голодание сухое разной продолжительности.. Как-то по любым видам голодания у нас с вами была небольшая дискуссия в комментах, рад, что обратили внимание на этот метод.
– Русская баня и финская сауна.
– Обильное питьё.
– Аэробные нагрузки.
– Употребление пищевой соды по доктору Неумывакину. Делает pH крови естественным, т.е., слабощелочным и растворяет кальций с его соединениями в сосудах и органах.
Конечно, не всё из перечисленного омолаживает внеклеточный матрикс, возможно, даже ничего из… Но не факт, что перечисленное влияет только на базовую уязвимость. Вскрытие, то есть, наблюдения и исследования, покажет. ))-
Алексей Москальков09 ноября 2022, 12:52
Адам+Палюхович- за голоданием к сат марге
-
-
Олег08 ноября 2022, 16:23
“Бактериальная терапия – как один из путей продления жизни” – речь о питательных и конструктивных блоках бактерий для построения митохондрий в “стареющем организме”. Это ти есть рекомендация посвящённая старению митохондрий, бывших бактерий.
-
Юрий Саламатов08 ноября 2022, 16:06
Отличная статья!
Свежие комментарии
Подпишитесь на свежие статьи
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить.