Дата создания: 8 августа 2019
Обновлено: 27 декабря 2023
Старение внеклеточного матрикса – возможно, основная причина старения и смерти человека. Часть 2
Омолодят ли человека стволовые клетки, повышение уровня NAD+, уничтожение сенесцентных (стареющих) клеток сенолитиками, терапия, снижающая системное воспаление, борьба со свободными радикалами, удлинение теломеров, улучшение митохондрий, эпигенетический откат? Что там еще модно, хайпово сегодня? Ответ - нет! Потому, что все попытки сделать клетки организма молодыми разобьются о старый внеклеточный матрикс, который эти клетки обратно состарит. И наоборот, в молодом внеклеточном матриксе клетки могут омолаживаться. И если мы хотим победить старение, мы должны научиться омолаживать внеклеточный матрикс, а уже потом, если это будет нужно, можно будет применять все остальное. Об этом читайте в этой статье.
 Цитата: "Людям свойственно мечтать, и мечты эти самые разные: об интересном деле, материальном благополучии, здоровье или, как у Ассоль, о любви под алыми парусами. Но всегда существовала неизменная мечта - мечта о бессмертии, - и при том на Земле, а не на Небесах. И вот, благодаря зарождающимся технологиям (наномедицина, генная инженерия и др.), самая заветная мечта человечества скоро начнёт сбываться! Однако здравствуйте! Меня зовут Дмитрий и я с удовольствием расскажу Вам всё, чтоб Вы уже сегодня могли использовать такие средства, которые позволят Вам прожить до 120 и более лет. То есть, наверняка дожить до времени, когда старение будет побеждено и люди станут жить неопределённо долго, оставаясь всегда молодыми!"
Цитата: "Людям свойственно мечтать, и мечты эти самые разные: об интересном деле, материальном благополучии, здоровье или, как у Ассоль, о любви под алыми парусами. Но всегда существовала неизменная мечта - мечта о бессмертии, - и при том на Земле, а не на Небесах. И вот, благодаря зарождающимся технологиям (наномедицина, генная инженерия и др.), самая заветная мечта человечества скоро начнёт сбываться! Однако здравствуйте! Меня зовут Дмитрий и я с удовольствием расскажу Вам всё, чтоб Вы уже сегодня могли использовать такие средства, которые позволят Вам прожить до 120 и более лет. То есть, наверняка дожить до времени, когда старение будет побеждено и люди станут жить неопределённо долго, оставаясь всегда молодыми!"
Именно с таких слов в 2006 году начинался сайт Дмитрия, которого теперь с нами больше нет, а архив его сайта можно почитать здесь: http://parus.web.ur.ru (старое название сайта http://bessmertie.ru)
Теперь его дело продолжают многие, в том числе и я. Нет, нет. Я пока не спешу умирать. Дмитрий страдал редким наследственным заболеванием. И он боролся за жизнь. Меня могут заставить умереть только недоброжелатели.
Тем не менее. В те годы, когда Дмитрий был жив, мечта о бессмертии казалась такой близкой. Ученые открывали так много всего о старении. Но каждый раз все гипотезы старения разбивались о неприступную стену. Несмотря на то, что мышам уже пытались вроде как омолаживать все, что только можно было омолодить, мыши умирали, не прожив в два раза дольше их нормальной продолжительности жизни. А у людей еще все сложнее. Почти никто из нас похоже не сможет прожить больше 100 лет. И только счастливчики доживут до 101-117 лет. Ученые всячески омолаживают клетки, но время берет свое и животные умирают. А омоложение клеток не помогает. Мы может уже продлить жизнь лет до 90-100, но нам этого мало для такой красивой мечты, которой заразил нас всех Дмитрий.
Самое интересное, что природа этого ограничительного барьера была открыта еще 100 лет назад. Но с тех пор так и ничего не было в этом направлении серьезного сделано. В предыдущей части я описал природу этого барьера. Можно прочитать в статье "Старение внеклеточного матрикса — возможно главная причина ограничения продолжительности жизни у людей". Теперь в вкратце напомню содержание прошлой статьи:
 Основная причина старения человека, вероятно, лежит в старении внеклеточного матрикса. Несмотря на то, что мы не умеем омолаживать матрикс человека, теперь мы лучше знаем, что такое старение. А значит имеем большие шансы победить его. Но для этого нужно правильно фокусировать научные усилия. В течение 100 лет с момента открытия старения внеклеточного матрикса, мы искали причину старения в клетке и не задумывались, что она может быть во внеклеточном матриксе. С тех пор было проведено много попыток омолодить клетки, но ни одной удачной попытки омолодить внеклеточный матрикс пожилого человека.
Основная причина старения человека, вероятно, лежит в старении внеклеточного матрикса. Несмотря на то, что мы не умеем омолаживать матрикс человека, теперь мы лучше знаем, что такое старение. А значит имеем большие шансы победить его. Но для этого нужно правильно фокусировать научные усилия. В течение 100 лет с момента открытия старения внеклеточного матрикса, мы искали причину старения в клетке и не задумывались, что она может быть во внеклеточном матриксе. С тех пор было проведено много попыток омолодить клетки, но ни одной удачной попытки омолодить внеклеточный матрикс пожилого человека.- Всю жизнь человека матрикс стареет - коллагеновые волокна сшиваются. Но пока человек растет, концентрация "сшивок" разбавляется. Когда организм перестает расти, концентрация сшивок увеличивается, а матрикс становится все более жестким. Сшивки делают неэластичными сердце, сосуды и т.п. Когда отвердение тканей из-за "сшивок" в матриксе достигает угрожающих жизни масштабов, человек умирает от старости. В этот момент омоложение клеток уже не спасет жизнь человека - это предел.
- Старый матрикс заставляет наши клетки стареть. А молодой матрикс может омолодить старые клетки до молодого состояния.
- Эволюция научилась обходить старение матрикса простым способом. Одна из клеток создает нового ребенка, организм которого отстраивает для себя новый матрикс с нуля. А бессмертные планарии все время растут и делятся, концентрация их "сшивок" разбавляется по мере роста животных. Это не значит, что устранить повреждения матрикса невозможно. Научиться омолаживать матрикс - это задача на следующие 20-30 лет, а может быть и на весь 21 век.
- Благодарю Александра Фединцева за предоставленную информацию и идеи, благодаря которым была написана предыдущая статья. Несмотря на то, что старение матрикса было открыто около 100 лет назад, ничего в этой области серьезного не было сделано. Научная деятельность Александра позволила взглянуть на матрикс, как на ключевую проблему, из-за которой стареет человек, и предположить, что именно омоложение внеклеточного матрикса - ключ к радикальному продлению жизни.
А теперь давайте продолжим путешествие в недры этой древней проблемы, которую не удалось победить природе. Но, что не под силу человеку. Мы и в космос полетели. Победим и старение, хотя многие из нас возможно не доживут до нашей общей победы. Но мы никогда не сдадимся. Ведь нам терять нечего.
Внеклеточный матрикс окружает клетки организма и передает им команды, через специальные рецепторы, диктуя их судьбу. С возрастом внеклеточный матрикс становится более жестким из-за кальцификации, накопления поперечных сшивок, удаления гликозаминогликанов и др. Повышенное сшивание коллагена с возрастом, превращает молодые клетки в старые, вызывает атеросклероз сосудов, способствует прогрессированию опухоли.
По теории заговора существует группа людей, управляющих миром. Теория предполагает, что президенты ничего не решают, а являются лишь номинальными правителями. Настоящая правящая элита находится в "тени". Правдива ли теория заговора или нет, мы, вероятно, точно не узнаем. Но если бы это было правдой, то в нашем организме именно все так и происходит. На первый взгляд кажется, что все решают клетки. Но правящий внеклеточный матрикс, окружающий клетки, посылает им четкие приказы. Приказ умереть, приказ заболеть, приказ перестать делится, приказ не трогать раковые опухоли, так же как не трогать мафию и т.д. Когда внеклеточный матрикс стареет, то идет ко дну и забирает клетки за собой. А мнение клеток его не интересует. Без решения проблемы со старением внеклеточного матрикса и прочих долгоживущих протеинов - большинство биотехнологий омоложения могут увеличить healthspan, но не максимальную видовую продолжительность жизни человека.
Все ткани и органы живого организма содержат смесь клеток и внеклеточных компонентов, которые образуют внеклеточный матрикс. Внеклеточный матрикс обеспечивает не только физический каркасы, в который встроены клетки, но и регулирует многие клеточные процессы, включая рост, миграцию, дифференцировку, выживание, гомеостаз и морфогенез. От состояния внеклеточного матрикса зависит судьба клеток. Старая клетка, или молодая - во многом решает внеклеточный матрикс. Состав внеклеточного матрикса сильно зависит от ткани. Но основные его компоненты, встречающиеся в большинстве тканей - это гликопротеины, протеогликаны и гиалуроновая кислота. Коллаген является превалирующим гликопротеином внеклеточного матрикса у большинства животных. В состав внеклеточного матрикса входит множество других компонентов: белки фибрин, эластин, а также фибронектины, ламинины и нидогены; в состав внеклеточного матрикса костной ткани входят минералы, такие как гидроксиапатит; можно считать внеклеточным матриксом и компоненты жидких соединительных тканей — плазму крови и лимфатическую жидкость.
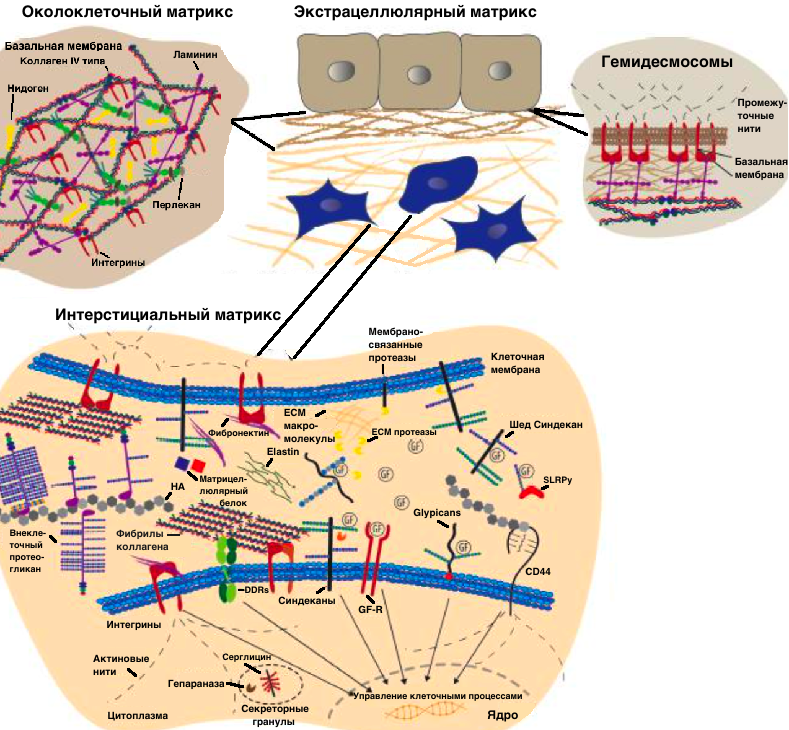 В большинстве тканей коллаген I типа, а в хрящевой ткани коллаген II типа, составляют основу внеклеточного матрикса. Внеклеточный матрикс можно разделить на основные два типа: интерстициальный и околоклеточной матрикс (смотрите рисунок - кликните по картинке, чтобы увеличить). Интерстициальный матрикс окружает клетки, а околоклеточной матрикс находится в тесном контакте с клетками. Например, базальная мембрана, которая является типом околоклеточного матрикса, находится на границе между паренхимой и соединительной тканью, обеспечивая закрепляющий листовидный слой для паренхиматозных клеток, чтобы удерживаться вместе, предотвращая их разрыв. Базальные мембраны состоят из коллагена типа IV, ламининов, нидогена 1 и 2, а также перлекана, агрина, коллагена XV типа и коллагена XVIII типа. Полимер ламинин в базальных мембранах обеспечивает в основном участки сцепления эпителиальных клеток и сети коллагеновых волокон IV типа, которая стабилизирует общую структуру. Обе сети взаимодействуют с другими компонентами базальной мембраны, которые действуют как молекулярные линкеры, соединяющие две сети. Например, перлекансодержащие агрегаты участвуют в плотном соединении коллагеновых сетей IV типа и ламинина, но также влияют на гидратацию (присоединение молекул воды к молекулам или ионам) и, следовательно, на биомеханические свойства базальных мембран.
В большинстве тканей коллаген I типа, а в хрящевой ткани коллаген II типа, составляют основу внеклеточного матрикса. Внеклеточный матрикс можно разделить на основные два типа: интерстициальный и околоклеточной матрикс (смотрите рисунок - кликните по картинке, чтобы увеличить). Интерстициальный матрикс окружает клетки, а околоклеточной матрикс находится в тесном контакте с клетками. Например, базальная мембрана, которая является типом околоклеточного матрикса, находится на границе между паренхимой и соединительной тканью, обеспечивая закрепляющий листовидный слой для паренхиматозных клеток, чтобы удерживаться вместе, предотвращая их разрыв. Базальные мембраны состоят из коллагена типа IV, ламининов, нидогена 1 и 2, а также перлекана, агрина, коллагена XV типа и коллагена XVIII типа. Полимер ламинин в базальных мембранах обеспечивает в основном участки сцепления эпителиальных клеток и сети коллагеновых волокон IV типа, которая стабилизирует общую структуру. Обе сети взаимодействуют с другими компонентами базальной мембраны, которые действуют как молекулярные линкеры, соединяющие две сети. Например, перлекансодержащие агрегаты участвуют в плотном соединении коллагеновых сетей IV типа и ламинина, но также влияют на гидратацию (присоединение молекул воды к молекулам или ионам) и, следовательно, на биомеханические свойства базальных мембран.
Эпителиальные клетки прикрепляются к базальной мембране с помощью специальных структур по имени гемидесмосомы (на рисунке в верхнем правом углу). Они образуются при взаимодействии интегринов клеточной поверхности с ламининами на внеклеточном уровне и внутриклеточно с промежуточными нитями.
Клетки, встроенные во внеклеточный матрикс, взаимодействуют с сетью макромолекул через рецепторы на поверхности клеток, такие как интегрины, рецепторы домена дискоидина (DDRs - зеленым цветом на нижнем рисунке), протеогликаны клеточной поверхности, гиалуроновой кислоты (HA) рецепторы CD44. Таким образом, внеклеточный матрикс с помощью сигналов через различные рецепторы диктует тем, какие должны выполнять функции клетки, и управляет их поведением. (Примечание: даже молодые клетки в старом внеклеточном матриксе быстро приобретают фенотип стареющих и наоборот, что ставит под сомнение все терапии по омоложение клеток в принципе).
Все типы клеток (эпителиальные, фибробласты, иммунные клетки, эндотелиальные клетки) синтезируют и секретируют матричные макромолекулы под контролем множественных сигналов, таким образом участвуя в формировании внеклеточного матрикса. Изменения в составе и структуре компонентов внеклеточного матрикса влияют как на общую структуру матрикса и биомеханические свойства формируемой сети, так и на сигналы, передаваемые клеткам, тем самым модулируя их ответы.
 Возраст, морщины, безысходность, мудрость, а потом и маразм. Морщины - это наглядный пример старения внеклеточного матрикса. Люди давно смирились. Настолько, что даже сочиняют стихи, радуясь тому, что все идет по плану, все идет ко дну. Вот например:
Возраст, морщины, безысходность, мудрость, а потом и маразм. Морщины - это наглядный пример старения внеклеточного матрикса. Люди давно смирились. Настолько, что даже сочиняют стихи, радуясь тому, что все идет по плану, все идет ко дну. Вот например:
Мне нравится мой возраст, я горжусь!
И никогда его я не скрываю.
И выглядеть моложе не стремлюсь,
И выходя из дома улыбаюсь.
Грустить сейчас не нахожу причин,
Здорова я, здоровы мои дети.
А несколько полосочек морщин,
Я не считаю вестниками смерти.
Состояние внеклеточного матрикса имеет решающее значение для нормального гомеостаза. Многие синдромы и патологические/смертельные состояния организма возникают из-за аномалий в компонентах внеклеточного матрикса. Например, во время опухлого процесса происходят выраженные изменения внеклеточного матрикса, приводящие к образованию фиброзной стромы с повышенной жесткостью, избыточному отложению компонентов внеклеточного матрикса и к высвобождению протеолитических ферментов, что при активации приводит к аномальному ремоделированию внеклеточного матрикса. Протеолитическая деградация, опосредованная ферментами, такими как матриксные металлопротеиназы (MMPs), дезинтегрины и металлопротеазы (ADAMs), ADAMs с мотивами тромбоспондина (ADAMTSs), тканевые активаторы плазминогена, а также деградация гепарансульфата (HS), освобождают гепарин-связывающие факторы роста, активирующие ангиогенез и рост раковых клеток. Более подробно о компонентах внеклеточного матрикса, их структуре, взаимодействии и функциях читайте в исследовательской работе по ссылке (www.ncbi.nlm.nih.gov/pubmed/26562801).
Еще со студенческой скамьи я запомнил выражение: "Если хочешь разобраться в предмете - напиши учебник". Вы думаете, что я так хорошо знал строение матрикса и всех деталей? Нет. Вот и пишу это, а заодно и сам разбираюсь. Ведь прочтут же критики. Будут докапываться до мелочей. Будут ругать. Нужно не ударить лицом в грязь. Будут читать и ученые биологи, генетики. Я почти не имею права на ошибку. Не очень понятные термины приходится уточнять в достоверных источниках. Зато потом эти знания останутся со мной. А еще я же буду читать лекции в присутствии врачей и ученых. Ох как тщательно нужно готовиться. И да. Вам также придется несладко. Читайте, вникайте. Без основательного знания "мировой элиты, правящей миром (то есть клетками)" нам не победить. Эта статья невероятно важно для всех нас. Наберитесь терпения. Будет нелегко. Но если вы хотите жить долго, вы справитесь.
 Коллаген составляет до 30% от общего количества белков в организме человека. Синтезируется и секретируется во внеклеточном матриксе главным образом фибробластами. Суперсемейство коллагена состоит из двадцати восьми различных типов коллагена. Коллаген I типа является основным структурным элементом в тканях, таких как кожа, кости, сухожилия, и т. д. Он образует идеальные гетеротримерные тройные спирали, которые самособираются в фибриллы. Коллагены отличаются друг от друга по своей структуре и свойствам. Например, некоторые типы коллагена имеют перерывы в тройной спирали и не самособираются, тогда как другие, такие как трансмембранные коллагены, представляют собой длительные перерывы и играют важную роль в клеточной сигнализации и адгезии. Повышенное сшивание коллагена опосредуется лизилоксидазными и лизилоксидазно подобными ферментами и способствует передаче сигналов через коллагенсвязывающие рецепторы клеточной поверхности, такие как интегрины и DDRs, способствуя прогрессированию опухоли. С возрастом сшивки волокон коллагена накапливаются. Тем больше возникает благоприятная среда для прогрессирования опухолей, чем старше человек. Ингибирование активности лизилоксидазы с помощью таких специфических ингибиторов, как AB0023, может предотвратить "застывание" внеклеточного матрикса и тем самым облегчить проникновение вводимых препаратов (www.ncbi.nlm.nih.gov/pubmed/20818376).
Коллаген составляет до 30% от общего количества белков в организме человека. Синтезируется и секретируется во внеклеточном матриксе главным образом фибробластами. Суперсемейство коллагена состоит из двадцати восьми различных типов коллагена. Коллаген I типа является основным структурным элементом в тканях, таких как кожа, кости, сухожилия, и т. д. Он образует идеальные гетеротримерные тройные спирали, которые самособираются в фибриллы. Коллагены отличаются друг от друга по своей структуре и свойствам. Например, некоторые типы коллагена имеют перерывы в тройной спирали и не самособираются, тогда как другие, такие как трансмембранные коллагены, представляют собой длительные перерывы и играют важную роль в клеточной сигнализации и адгезии. Повышенное сшивание коллагена опосредуется лизилоксидазными и лизилоксидазно подобными ферментами и способствует передаче сигналов через коллагенсвязывающие рецепторы клеточной поверхности, такие как интегрины и DDRs, способствуя прогрессированию опухоли. С возрастом сшивки волокон коллагена накапливаются. Тем больше возникает благоприятная среда для прогрессирования опухолей, чем старше человек. Ингибирование активности лизилоксидазы с помощью таких специфических ингибиторов, как AB0023, может предотвратить "застывание" внеклеточного матрикса и тем самым облегчить проникновение вводимых препаратов (www.ncbi.nlm.nih.gov/pubmed/20818376).
В настоящее время микроокружение и внеклеточный матрикс, в котором прогрессируют заболевания, считаются столь же важным, как и клеточные популяции, вовлеченные в развитие патологических состояний. Например, здоровое микроокружение препятствует раковому разрастанию эпителиальных клеток, тогда как нарушение гомеостаза способствует инициации и прогрессированию злокачественности, а также возникновению резистентности. Хотя много внимания в лечение рака было сфокусировано на терапиях воздействия на раковые клетки, интерес к воздействию на сам внеклеточный матрикс быстро растет в последние десятилетия.
 Многие считают, для того чтобы разобрать старый дом, особых знаний и навыков не нужно, но это ошибочное мнение. Снести старое здание не менее сложно, чем возвести новое. Также не стоит думать, что профессиональные строители, которые хорошо возводят дома, могут также качественно демонтировать их. Для сноса построек привлекаются специализированная техника и рабочие руки. Внеклеточный матрикс - это дом, в котором живут клетки. И он постоянно обновляется. Иначе мы состаримся слишком быстро. Так же как и в строительстве, "сносов" старых элементов внеклеточного матрикса занимаются "специальные руководители, рабочие и специальная техника" под кодовыми названиями: MMPs, ADAMs, ADAMTSs, Меприны (α и β), TIMP, CatK и др. А от их правильной работы зависят жизнь или смерть, здоровье или болезнь.
Многие считают, для того чтобы разобрать старый дом, особых знаний и навыков не нужно, но это ошибочное мнение. Снести старое здание не менее сложно, чем возвести новое. Также не стоит думать, что профессиональные строители, которые хорошо возводят дома, могут также качественно демонтировать их. Для сноса построек привлекаются специализированная техника и рабочие руки. Внеклеточный матрикс - это дом, в котором живут клетки. И он постоянно обновляется. Иначе мы состаримся слишком быстро. Так же как и в строительстве, "сносов" старых элементов внеклеточного матрикса занимаются "специальные руководители, рабочие и специальная техника" под кодовыми названиями: MMPs, ADAMs, ADAMTSs, Меприны (α и β), TIMP, CatK и др. А от их правильной работы зависят жизнь или смерть, здоровье или болезнь.
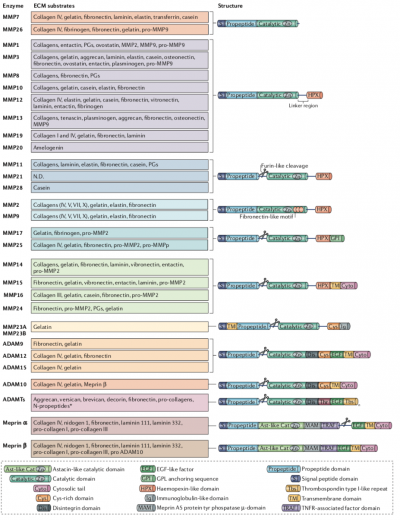 Дисрегулируемое ремоделирование внеклеточного матрикса связано с патологическими состояниями и может усугубить прогрессирование многих заболеваний. Например, аномальное отложение внеклеточного матрикса и его жесткость наблюдаются при фиброзе и онкологических заболеваниях. А чрезмерное разрушение (деградация) внеклеточного матрикса связано с остеоартритом. Матриксные металлопротеиназы (MMPs) являются основными ферментами, участвующими в деградации внеклеточного матрикса. В меньшей степени в деградации матрикса участвуют дезинтегрины и металлопротеазы (ADAMs), ADAMs с мотивами тромбоспондина (ADAMTSs). Когда человек здоров, то MMPs малоактивны. Но когда происходит регенерация тканей, ремоделирование органа, воспалительный процесс, некоторые заболевания, то активность MMPs возрастает. MMPs были обнаружены в 1962 году при изучении ремоделирования коллагена. В настоящее время известно 23 вида MMPs человека. В совокупности MMPs могут разрушать все белки внеклеточного матрикса (смотрите рисунок - кликните по картинке, чтобы увеличить). Меприны (α и β) могут расщеплять белки внеклеточного матрикса, такие как коллаген IV, нидоген и фибронектин. Меприны (β) расщепляют ADAM10, и как меприн-α, так и меприн-β косвенно способствуют ускорению активации MMP9. По сравнению с другими металло-протеиназами роль мепринов в ремоделировании внеклеточного матрикса изучена недостаточно.
Дисрегулируемое ремоделирование внеклеточного матрикса связано с патологическими состояниями и может усугубить прогрессирование многих заболеваний. Например, аномальное отложение внеклеточного матрикса и его жесткость наблюдаются при фиброзе и онкологических заболеваниях. А чрезмерное разрушение (деградация) внеклеточного матрикса связано с остеоартритом. Матриксные металлопротеиназы (MMPs) являются основными ферментами, участвующими в деградации внеклеточного матрикса. В меньшей степени в деградации матрикса участвуют дезинтегрины и металлопротеазы (ADAMs), ADAMs с мотивами тромбоспондина (ADAMTSs). Когда человек здоров, то MMPs малоактивны. Но когда происходит регенерация тканей, ремоделирование органа, воспалительный процесс, некоторые заболевания, то активность MMPs возрастает. MMPs были обнаружены в 1962 году при изучении ремоделирования коллагена. В настоящее время известно 23 вида MMPs человека. В совокупности MMPs могут разрушать все белки внеклеточного матрикса (смотрите рисунок - кликните по картинке, чтобы увеличить). Меприны (α и β) могут расщеплять белки внеклеточного матрикса, такие как коллаген IV, нидоген и фибронектин. Меприны (β) расщепляют ADAM10, и как меприн-α, так и меприн-β косвенно способствуют ускорению активации MMP9. По сравнению с другими металло-протеиназами роль мепринов в ремоделировании внеклеточного матрикса изучена недостаточно.
Тканевые ингибиторы матричных металлопротеиназ (TIMP) состоят из четырех членов (TIMP1–TIMP4), которые обратимо ингибируют (подавляют) активность MMPs, ADAMs и ADAMTS, но не меприны. Цистатин с, элафин и фетуин были идентифицированы как природные ингибиторы мепринов.
 Чрезмерная активность ферментов, участвующих в деградации внеклеточного матрикса связана с патологическими состояниями и может усугубить прогрессирование многих заболеваний. Так аномально высокие уровни экспрессии MMP1, специфичной для сердца, приводят к потере коллагена и к снижению сократимости сердечной мышцы, что приводит к кардиомиопатии. Чрезмерно высокие уровни экспрессии ADAMTS4 и ADAMTS5 частично ответственны за патологическое разрушение внеклеточного матрикса при остеоартрите. Мутации, приводящие к снижению экспрессии MMP2, также вызывают тяжелый остеолитический и артритный синдромы. Это парадоксальное открытие, что дефицит протеазы также, как и чрезмерная активность, приводит к остеолизу и артриту, показывает, что нормальный гомеостаз костей и хрящей зависит от сбалансированных распада и синтеза внеклеточного матрикса. Именно поэтому нельзя бесконтрольно употреблять ингибиторы MMP, например, доксициклин. Основанием применения доксициклина является повышенная активность MMP. Перекос вверх и вниз в уровне MMP может привести к аналогичным результатам.
Чрезмерная активность ферментов, участвующих в деградации внеклеточного матрикса связана с патологическими состояниями и может усугубить прогрессирование многих заболеваний. Так аномально высокие уровни экспрессии MMP1, специфичной для сердца, приводят к потере коллагена и к снижению сократимости сердечной мышцы, что приводит к кардиомиопатии. Чрезмерно высокие уровни экспрессии ADAMTS4 и ADAMTS5 частично ответственны за патологическое разрушение внеклеточного матрикса при остеоартрите. Мутации, приводящие к снижению экспрессии MMP2, также вызывают тяжелый остеолитический и артритный синдромы. Это парадоксальное открытие, что дефицит протеазы также, как и чрезмерная активность, приводит к остеолизу и артриту, показывает, что нормальный гомеостаз костей и хрящей зависит от сбалансированных распада и синтеза внеклеточного матрикса. Именно поэтому нельзя бесконтрольно употреблять ингибиторы MMP, например, доксициклин. Основанием применения доксициклина является повышенная активность MMP. Перекос вверх и вниз в уровне MMP может привести к аналогичным результатам.
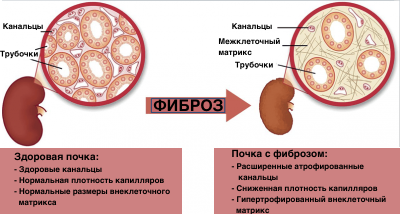 Хронические или тяжелые повреждения тканей, приводящие к избыточной продукции внеклеточного матрикса без взаимно сбалансированной деградации, могут привести к перекосу баланса - к фиброзу. Например, постоянное повреждение печени приводит к органной недостаточности, такой как цирроз печени из-за фиброза. Другое известное явление - миелофиброз костного мозга. Фиброз также увеличивает риск рака; например, цирроз печени увеличивает риск гепатоцеллюлярной карциномы на 20-30%, а повышенная маммографическая плотность, которая отражает количество коллагена в молочной железе, коррелирует с повышенным риском рака молочной железы. Фиброз опосредуется главным образом фибробластами или миофибробластами, а также другими стромальными клетками. Путь TGF-β является, пожалуй, наиболее хорошо изученным и мощным стимулятором фиброза.
Хронические или тяжелые повреждения тканей, приводящие к избыточной продукции внеклеточного матрикса без взаимно сбалансированной деградации, могут привести к перекосу баланса - к фиброзу. Например, постоянное повреждение печени приводит к органной недостаточности, такой как цирроз печени из-за фиброза. Другое известное явление - миелофиброз костного мозга. Фиброз также увеличивает риск рака; например, цирроз печени увеличивает риск гепатоцеллюлярной карциномы на 20-30%, а повышенная маммографическая плотность, которая отражает количество коллагена в молочной железе, коррелирует с повышенным риском рака молочной железы. Фиброз опосредуется главным образом фибробластами или миофибробластами, а также другими стромальными клетками. Путь TGF-β является, пожалуй, наиболее хорошо изученным и мощным стимулятором фиброза.
 Феномен долгоживущего и не болеющего раком грызуна (голого землекопа - на картинке слева) — кладезь полезной информации для биологов и медиков. Внеклеточный матрикс вполне может задерживать рост раковых опухолей, если находится в нормальном состоянии. Например, высокомолекулярный гиалуронан (то есть более чем в пять раз больше, чем гиалуронан человека или мыши) защищает от рака голых землекопов. Гиалуроновая кислота - это важный компонент внеклеточного матрикса. Она заполняет пространство между клетками, обеспечивает эластичность тканей, вязкость синовиальной жидкости в суставах и т. д. Но это не просто связующее вещество: гиалуроновая кислота также контролирует поведение клеток путем взаимодействия с рецепторами на поверхности клеточной мембраны. Более жесткий внеклеточный матрикс способствует росту раковых опухолей. И наоборот, гиалуроновая кислота делает внеклеточный матрикс более мягким. Таким образом, она может остановить развитие злокачественной опухоли на очень ранней, предраковой стадии, когда клетки еще только начали трансформацию.
Феномен долгоживущего и не болеющего раком грызуна (голого землекопа - на картинке слева) — кладезь полезной информации для биологов и медиков. Внеклеточный матрикс вполне может задерживать рост раковых опухолей, если находится в нормальном состоянии. Например, высокомолекулярный гиалуронан (то есть более чем в пять раз больше, чем гиалуронан человека или мыши) защищает от рака голых землекопов. Гиалуроновая кислота - это важный компонент внеклеточного матрикса. Она заполняет пространство между клетками, обеспечивает эластичность тканей, вязкость синовиальной жидкости в суставах и т. д. Но это не просто связующее вещество: гиалуроновая кислота также контролирует поведение клеток путем взаимодействия с рецепторами на поверхности клеточной мембраны. Более жесткий внеклеточный матрикс способствует росту раковых опухолей. И наоборот, гиалуроновая кислота делает внеклеточный матрикс более мягким. Таким образом, она может остановить развитие злокачественной опухоли на очень ранней, предраковой стадии, когда клетки еще только начали трансформацию.
И так, внеклеточный матрикс вполне может задерживать рост раковых опухолей, если находится в нормальном состоянии у молодого организма. И наоборот, внеклеточный матрикс может повышать прогрессирование опухолей, если в нем происходят отличные от нормы изменения. Например, сверхэкспрессия коллагена IV повышает выживаемость клеток и обеспечивает преимущество роста клеток рака легких в печени. Опухоли с высокой экспрессией ингибиторов MMP коррелируют с хорошим прогнозом, тогда как опухоли с высокой MMP коррелируют с плохим прогнозом и повышенным риском рецидива. А высокая экспрессия MMP1 стратифицирует атипичную протоковую гиперплазию в доброкачественные и предраковые поражения.
Более жесткий матрикс способствует росту раковых опухолей. Например, усиление жесткости внеклеточного матрикса, индуцированное повышенным отложением коллагена и поперечными сшивками, нарушает морфогенез тканей и способствует злокачественному прогрессированию. А ведь с возрастом в результате старения сшивки коллагена внеклеточного матрикса накапливаются, имитируя фиброз. Фиброз усугубляет жесткость. Риск рака все выше по мере старения из-за возрастного нарастания жесткости матрикса. Повышенное сшивание коллагена опосредуется лизилоксидазными и лизилоксидазно подобными ферментами и способствует передаче сигналов через коллагенсвязывающие рецепторы клеточной поверхности, такие как интегрины и DDRs, способствуя прогрессированию опухоли. А лизилоксидазные и лизилоксидазно подобные ферменты часто повышены во многих видах раков и в местах метастазирования раковых опухолей. А пациенты с высоким уровнем лизилоксидазных ферментов имеют плохое выживание (www.ncbi.nlm.nih.gov/pubmed/25415508)
 Перепроизводство эластина в стенках сосудов, способствует развитию атеросклероза (на рисунке слева - эластин, выделенный из стенки аорты) "overproduction of elastin in vascular walls contributes to the development of atherosclerosis" VGVAPGпредставляет собой фрагмент эластинового пептида, который является хемотаксическим как для моноцитов, так и для фибробластов "VGVAPG is an elastin peptide fragment that is chemotactic for both monocytes and fibroblasts." VGVAPG приводит к миграции гладких мышц, что приводит к утолщению сосудистой интимы и развитию сосудистых заболеваний
Перепроизводство эластина в стенках сосудов, способствует развитию атеросклероза (на рисунке слева - эластин, выделенный из стенки аорты) "overproduction of elastin in vascular walls contributes to the development of atherosclerosis" VGVAPGпредставляет собой фрагмент эластинового пептида, который является хемотаксическим как для моноцитов, так и для фибробластов "VGVAPG is an elastin peptide fragment that is chemotactic for both monocytes and fibroblasts." VGVAPG приводит к миграции гладких мышц, что приводит к утолщению сосудистой интимы и развитию сосудистых заболеваний
- www.ncbi.nlm.nih.gov/pubmed/26562801
Пролиферация (разрастание) гладкомышечных клеток сосудов (VSMCs) имеет решающее значение для гиперплазии комплекса интим медиа, являющейся распространенным и тяжелым патофизиологическим процессом, который способствует атеросклерозу. В итоге артерии зарастают, как старые чугунные батареи. В ответ на повреждение или другие стимулы, под действием серин / аргинин сплайсинг фактора 1 носители VSMCs мигрируют в интиму сосудов, начинают разрастаться и секретировать внеклеточный матрикс, что приводит к расширению артериальной интимы (КИМ), то есть образованию неоинтимы, что в дальнейшем может привести к тяжелым сердечно-сосудистым заболеваниям, таким как гипертония, ишемическая болезнь и последующий инфаркт миокарда, инсульт и застойная сердечная недостаточность. Иными словами, сосуды внутри утолщаются не из-за холестерина, а из-за разрастания внеклеточного матрикса. Благодарю Александра Фединцева за предоставление информации и своих комментариев. (www.nature.com/articles/ncomms16016).
В стареющем матриксе полное разрушение старого коллагена для обновления матрикса осуществляет катепсин К (CatK). Однако CatK не работает с удаленными гликозаминогликанами (GAGs), которые удаляются в процессе старения. Недоразрушенные участки накапливаются, повышая жесткость органов и тканей, что в итоге приводит к смерти. Также в молодом организме протеолитические ферменты не дают накапливаться рацемированным белкам. Однако, в тканях с замедленным метаболизмом из-за старения, количество рацемированных белков увеличивается. А поперечные сшивки коллагенов внеклеточного матрикса затрудняют доступ исправляющих ферментов к структурно измененным в результате рацемизации белкам, что также мешает заменять старые участки внеклеточного матрикса.
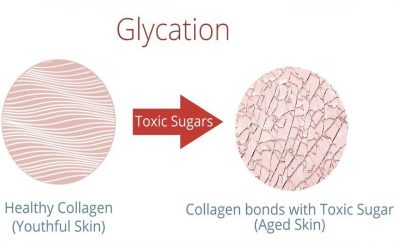 Вредные возрастные изменения во внеклеточном матриксе, которые проявляются в жесткости суставов, сосудистой системы и капилляров почек, а также сетчатки глаз, происходят в первую очередь из-за межмолекулярного «сшивания» молекул коллагена внеклеточного матрикса. В итоге ровная структура коллагеновых фибрилл искажается (смотрите картинку слева). Формирование перекрестных «сшивок» было продемонстрировано Верзаром еще более 40 лет назад. Сейчас уже известно, что этот процесс включает в себя два различных механизма: один строго контролируется с помощью ферментов в процессе развития и созревания, и происходит с постоянной скоростью, а второй случайный неферментативный, который зависит от многих факторов. Именно второй неферментативный известен, как гликация, включающий реакцию с глюкозой и с последующими продуктами окисления — является основной причиной ускоренного старения и испорченного коллагена внеклеточного матрикса в пожилом возрасте. Второй процесс может также ускоряться у больных сахарным диабетом из-за более высокого уровня глюкозы в анализах крови. Если бы на нас воздействовал только первый процесс, то старение протекало бы несколько медленнее (www.ncbi.nlm.nih.gov/pubmed/9883973).
Вредные возрастные изменения во внеклеточном матриксе, которые проявляются в жесткости суставов, сосудистой системы и капилляров почек, а также сетчатки глаз, происходят в первую очередь из-за межмолекулярного «сшивания» молекул коллагена внеклеточного матрикса. В итоге ровная структура коллагеновых фибрилл искажается (смотрите картинку слева). Формирование перекрестных «сшивок» было продемонстрировано Верзаром еще более 40 лет назад. Сейчас уже известно, что этот процесс включает в себя два различных механизма: один строго контролируется с помощью ферментов в процессе развития и созревания, и происходит с постоянной скоростью, а второй случайный неферментативный, который зависит от многих факторов. Именно второй неферментативный известен, как гликация, включающий реакцию с глюкозой и с последующими продуктами окисления — является основной причиной ускоренного старения и испорченного коллагена внеклеточного матрикса в пожилом возрасте. Второй процесс может также ускоряться у больных сахарным диабетом из-за более высокого уровня глюкозы в анализах крови. Если бы на нас воздействовал только первый процесс, то старение протекало бы несколько медленнее (www.ncbi.nlm.nih.gov/pubmed/9883973).
 Поперечные сшивки коллагенов внеклеточного матрикса затрудняют доступ протеолитических и исправляющих ферментов (l-isoaspartyl methyltransferase) к структурно измененным в результате рацемизации белкам (www.ncbi.nlm.nih.gov/pubmed/14729060)(www.ncbi.nlm.nih.gov/pubmed/29053339) Это способствует процессу накопления поврежденных белков в коллагене, что усугубляет ситуацию и негативно сказывается на механических свойствах тканей при старении (www.ncbi.nlm.nih.gov/pubmed/20308077). Без решения проблемы со старением внеклеточного матрикса и прочих долгоживущих протеинов - большинство биотехнологий омоложения могут увеличить healthspan, но не максимальную видовую продолжительность жизни человека.
Поперечные сшивки коллагенов внеклеточного матрикса затрудняют доступ протеолитических и исправляющих ферментов (l-isoaspartyl methyltransferase) к структурно измененным в результате рацемизации белкам (www.ncbi.nlm.nih.gov/pubmed/14729060)(www.ncbi.nlm.nih.gov/pubmed/29053339) Это способствует процессу накопления поврежденных белков в коллагене, что усугубляет ситуацию и негативно сказывается на механических свойствах тканей при старении (www.ncbi.nlm.nih.gov/pubmed/20308077). Без решения проблемы со старением внеклеточного матрикса и прочих долгоживущих протеинов - большинство биотехнологий омоложения могут увеличить healthspan, но не максимальную видовую продолжительность жизни человека.
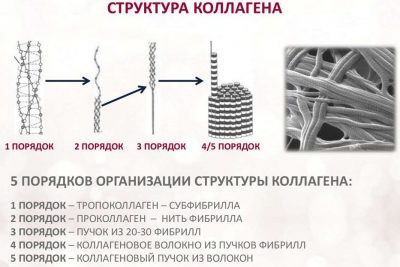 Коллагены являются доминирующими белками во внеклеточном матриксе и имеют очень низкие показатели текучести. Период полувыведения коллагена кожи (в первую очередь коллагена I типа) составляет около 14,8 лет, суставного хряща (в первую очередь коллагена II типа) - около 117 лет, а дентина (в первую очередь коллагена I типа) - 500 лет. То есть, чтобы заменить полностью хрящ, нужно подождать всего-то 117 лет, а чтобы обновить зубы - 500 лет. Но и это не все. Все еще хуже. Также известно, что протеолитические скорость оборота коллагена по мере старения человека уменьшается и составляет в возрасте от 50 до 80 лет примерно 1/2 скорости по сравнению с возрастной группой от 20 до 40 лет. Фибриллярные коллагены состоят из тройных спиральных коллагенов. Во время старения внеклеточный матрикс становится более жестким из-за кальцификации коллагена, сшивания коллагеновых волокон конечными продуктами гликирования, удаления или добавления гликозаминогликанов. Матриксные металлопротеиназы (MMPs) и катепсин К (CatK) являются основными факторами ремоделирования тканей и деградации "испорченного" коллагена, чтобы потом заменить его на новый. Модифицированные из-за старения фибриллы и волокна (минерализация, сшивка волокон конечными продуктами гликирования, удаление или добавление гликозаминогликанов) значительно хуже разрушаются с помощью MMPs. Иными словами - с возрастом ферменты, удаляющие «испорченный» коллаген, работают все хуже, что приводит к старению человека из-за нарастающей жесткости внеклеточного матрикса. Механические свойства волокон, такие как модуль Юнга, напряжение при разрыве и деформация при разрыве, указывают на повышенную жесткость и хрупкость при возрастной модификации или минерализации. Еще интересно, что матриксные металлопротеиназы (MMPs) менее способны к деградации и дестабилизации модифицированных из-за возраста волокон коллагена, чем катепсин К (CatK). Хотя CatK был описан как преобладающая коллагеназа в обороте внеклеточного матрикса костной ткани и, таким образом, мишень для лечения остеопороза и артрита, он также критически участвует в сердечно-сосудистых заболеваниях и может способствовать гомеостазу легочной ткани. Дефицит катепсина К (CatK) коррелирует с более низкими показателями разрыва бляшек и с повышенной стабильностью бляшек в моделях атеросклероза.
Коллагены являются доминирующими белками во внеклеточном матриксе и имеют очень низкие показатели текучести. Период полувыведения коллагена кожи (в первую очередь коллагена I типа) составляет около 14,8 лет, суставного хряща (в первую очередь коллагена II типа) - около 117 лет, а дентина (в первую очередь коллагена I типа) - 500 лет. То есть, чтобы заменить полностью хрящ, нужно подождать всего-то 117 лет, а чтобы обновить зубы - 500 лет. Но и это не все. Все еще хуже. Также известно, что протеолитические скорость оборота коллагена по мере старения человека уменьшается и составляет в возрасте от 50 до 80 лет примерно 1/2 скорости по сравнению с возрастной группой от 20 до 40 лет. Фибриллярные коллагены состоят из тройных спиральных коллагенов. Во время старения внеклеточный матрикс становится более жестким из-за кальцификации коллагена, сшивания коллагеновых волокон конечными продуктами гликирования, удаления или добавления гликозаминогликанов. Матриксные металлопротеиназы (MMPs) и катепсин К (CatK) являются основными факторами ремоделирования тканей и деградации "испорченного" коллагена, чтобы потом заменить его на новый. Модифицированные из-за старения фибриллы и волокна (минерализация, сшивка волокон конечными продуктами гликирования, удаление или добавление гликозаминогликанов) значительно хуже разрушаются с помощью MMPs. Иными словами - с возрастом ферменты, удаляющие «испорченный» коллаген, работают все хуже, что приводит к старению человека из-за нарастающей жесткости внеклеточного матрикса. Механические свойства волокон, такие как модуль Юнга, напряжение при разрыве и деформация при разрыве, указывают на повышенную жесткость и хрупкость при возрастной модификации или минерализации. Еще интересно, что матриксные металлопротеиназы (MMPs) менее способны к деградации и дестабилизации модифицированных из-за возраста волокон коллагена, чем катепсин К (CatK). Хотя CatK был описан как преобладающая коллагеназа в обороте внеклеточного матрикса костной ткани и, таким образом, мишень для лечения остеопороза и артрита, он также критически участвует в сердечно-сосудистых заболеваниях и может способствовать гомеостазу легочной ткани. Дефицит катепсина К (CatK) коррелирует с более низкими показателями разрыва бляшек и с повышенной стабильностью бляшек в моделях атеросклероза.
 Более того, у таких процессов старения внеклеточного матрикса есть и свои плюсы. Кальцификация артерий хоть и является фактором прогрессирования сердечно-сосудистых заболеваний, но меньше способствует неблагоприятным сердечно-сосудистым событиям, чем богатые липидами некальцифицированные атеросклеротические бляшки, поскольку кальцифицированные бляшки более стабильны. Снижение восприимчивости к матриксным металлопротеиназам и к катепсину К может служить одним из объяснений более высокой стабильности бляшек. Вот почему статины для снижения риска сердечно-сосудистой смертности на постоянной основе (не курсами) не стоит применять до определенного возраста и наличия факторов риска сердечно-сосудистых заболеваний. Так розувастатин может снижать активность эндотелиальных и моноцитарных матриксных металлопротеиназ, что, возможно, и является причиной уменьшения истончения фиброзного колпачка. Ингибирование матриксныхметаллопротеиназ и моноцитарного воспаления, индуцированное розувастатином, может играть определенную роль в увеличение толщины фиброзного колпачка, снижая риск разрыва бляшки (ncbi.nlm.nih.gov/pubmed/30851941). Хотя Катепсин К тоже участвует в деградации коллагена, как и матриксные металлопротеиназы, но между ними есть существенное отличие. Удаление "плохого" коллагена с помощью катепсина К сокращается при минерализации коллагена и его сшивании конечными продуктами гликирования, но полностью блокируется, когда удаляются гликозаминогликаны (GAGs) - опосредованный катепсином К (CatK) гидролиз сильно подавляетсяпри удалении гликозаминогликанов (GAGs), так как для своей активности катепсин К требует наличия гликозаминогликанов (GAGs). Но для матриксныхметаллопротеиназ гликозаминогликаны не важны. В одинаковых условиях молодые, не измененные фибриллы и фибриллы с удаленными гликозаминогликанами (GAGs) в эксперименте деградировались матрикснымиметаллопротеиназами примерно на 75% через 4 часа, тогда как минерализованные (кальцифицированные) и сшитые конечными продуктами гликирования фибриллы деградировались матриксными металлопротеиназами только до 40-50%.
Более того, у таких процессов старения внеклеточного матрикса есть и свои плюсы. Кальцификация артерий хоть и является фактором прогрессирования сердечно-сосудистых заболеваний, но меньше способствует неблагоприятным сердечно-сосудистым событиям, чем богатые липидами некальцифицированные атеросклеротические бляшки, поскольку кальцифицированные бляшки более стабильны. Снижение восприимчивости к матриксным металлопротеиназам и к катепсину К может служить одним из объяснений более высокой стабильности бляшек. Вот почему статины для снижения риска сердечно-сосудистой смертности на постоянной основе (не курсами) не стоит применять до определенного возраста и наличия факторов риска сердечно-сосудистых заболеваний. Так розувастатин может снижать активность эндотелиальных и моноцитарных матриксных металлопротеиназ, что, возможно, и является причиной уменьшения истончения фиброзного колпачка. Ингибирование матриксныхметаллопротеиназ и моноцитарного воспаления, индуцированное розувастатином, может играть определенную роль в увеличение толщины фиброзного колпачка, снижая риск разрыва бляшки (ncbi.nlm.nih.gov/pubmed/30851941). Хотя Катепсин К тоже участвует в деградации коллагена, как и матриксные металлопротеиназы, но между ними есть существенное отличие. Удаление "плохого" коллагена с помощью катепсина К сокращается при минерализации коллагена и его сшивании конечными продуктами гликирования, но полностью блокируется, когда удаляются гликозаминогликаны (GAGs) - опосредованный катепсином К (CatK) гидролиз сильно подавляетсяпри удалении гликозаминогликанов (GAGs), так как для своей активности катепсин К требует наличия гликозаминогликанов (GAGs). Но для матриксныхметаллопротеиназ гликозаминогликаны не важны. В одинаковых условиях молодые, не измененные фибриллы и фибриллы с удаленными гликозаминогликанами (GAGs) в эксперименте деградировались матрикснымиметаллопротеиназами примерно на 75% через 4 часа, тогда как минерализованные (кальцифицированные) и сшитые конечными продуктами гликирования фибриллы деградировались матриксными металлопротеиназами только до 40-50%.
 Однако, общая активность матриксных металлопротеиназ (MMPs) по отношению к новому и модифицированному коллагену, по-видимому, менее эффективна, чем у катепсина К (CatK). Это может быть связано с различными способами действия между двумя классами коллагеназ. MMPs расщепляет в определенном месте, близком к концу молекулы коллагена, тогда как катепсин К (CatK) расщепляет коллаген в нескольких местах и приводит к его полному разрушению, но не работает с удаленными гликозаминогликанами (GAGs), которые удаляются в процессе старения. Вот, вероятно, почему в процессе старения, если произошло полное удаление гликозаминогликанов (GAGs), то полное разрушение старого коллагена становится невозможным.
Однако, общая активность матриксных металлопротеиназ (MMPs) по отношению к новому и модифицированному коллагену, по-видимому, менее эффективна, чем у катепсина К (CatK). Это может быть связано с различными способами действия между двумя классами коллагеназ. MMPs расщепляет в определенном месте, близком к концу молекулы коллагена, тогда как катепсин К (CatK) расщепляет коллаген в нескольких местах и приводит к его полному разрушению, но не работает с удаленными гликозаминогликанами (GAGs), которые удаляются в процессе старения. Вот, вероятно, почему в процессе старения, если произошло полное удаление гликозаминогликанов (GAGs), то полное разрушение старого коллагена становится невозможным.
Последовательное и полное удаление коллагеновых единиц с поверхности фибрилл с помощью катепсина К приводит к истончению коллагеновых фибрилл и к окончательному их распаду на рыхлые микрофибриллы, подвергающиеся окончательной деструкции. Напротив, вовремя только лишь MMPs-опосредованной деградации без участия катепсина К коллагеновые фибриллы сохраняют свою общую структуру фибрилл, но становятся завитыми на поверхности, вероятно, оставляя остаток фрагментов 1⁄4 и 3⁄4 на поверхности фибрилл. Пока человек молодой, MMPsмогутрасщеплятьновые фрагменты коллагена, но этот механизм расщепления в одной конкретной точке не способствует полной деградации и растворению фибрилл.И молодому человеку на помощьидет мультисайтовая атака катепсина К (CatK), приводящая кполному разрушению коллагена, частично до этого разрушенного с помощью MMPs. Все части молекулы коллагена присутствующие на поверхности извлекутся, и доступ к основным молекулам коллагена будет открыт. Чего не наблюдается у старого человека. С возрастом такие недоразрушенные участки могут накапливаться, повышая жесткость органов и тканей, что в итоге приводит к смерти (www.sciencedirect.com/science/article/pii/S0945053X17301300).
Здесь я хочу поблагодарить Одинокова Дениса за дополнения. Кроме образования поперечных сшивок, белки также подвержены рацемизации. (www.ncbi.nlm.nih.gov/pubmed/1059082)(www.ncbi.nlm.nih.gov/pubmed/958370)(www.ncbi.nlm.nih.gov/pubmed/892449)(www.ncbi.nlm.nih.gov/pubmed/9466821)(www.ncbi.nlm.nih.gov/pubmed/12039448)(www.ncbi.nlm.nih.gov/pubmed/26417696)(www.ncbi.nlm.nih.gov/pubmed/29263613)
 Рацемизация — это спонтанный процесс, в результате которого происходит превращение оптически активных соединения в рацемическую смесь. Так, аминокислоты превращаются из L-формы в зеркальную D-форму (часть из них имеют свою биологическую активность). Рацемизация происходит во всех белках, но протеолитические ферменты не дают им накапливаться. Однако, в тканях с замедленным метаболизмом, количество рацемированных белков линейно увеличивается, например, в тканях зубов на 0,1% в год. Рацемизация — это процесс «естественного» старения белков, поэтому может использоваться в качестве молекулярного индикатора старения, а также для идентификации долгоживущих белков. Количественное измерение степени рацемизации аспарагиновой кислоты используется в криминалистике и судебно-медицинской экспертизе для определения возраста останков. Поперечные сшивки коллагенов внеклеточного матрикса затрудняют доступ протеолитических и исправляющих ферментов (l-isoaspartyl methyltransferase) к структурно измененным в результате рацемизации белкам (www.ncbi.nlm.nih.gov/pubmed/14729060)(www.ncbi.nlm.nih.gov/pubmed/29053339). Это способствует процессу накопления поврежденных белков в коллагене, что усугубляет ситуацию и негативно сказывается на механических свойствах тканей при старении (www.ncbi.nlm.nih.gov/pubmed/20308077).
Рацемизация — это спонтанный процесс, в результате которого происходит превращение оптически активных соединения в рацемическую смесь. Так, аминокислоты превращаются из L-формы в зеркальную D-форму (часть из них имеют свою биологическую активность). Рацемизация происходит во всех белках, но протеолитические ферменты не дают им накапливаться. Однако, в тканях с замедленным метаболизмом, количество рацемированных белков линейно увеличивается, например, в тканях зубов на 0,1% в год. Рацемизация — это процесс «естественного» старения белков, поэтому может использоваться в качестве молекулярного индикатора старения, а также для идентификации долгоживущих белков. Количественное измерение степени рацемизации аспарагиновой кислоты используется в криминалистике и судебно-медицинской экспертизе для определения возраста останков. Поперечные сшивки коллагенов внеклеточного матрикса затрудняют доступ протеолитических и исправляющих ферментов (l-isoaspartyl methyltransferase) к структурно измененным в результате рацемизации белкам (www.ncbi.nlm.nih.gov/pubmed/14729060)(www.ncbi.nlm.nih.gov/pubmed/29053339). Это способствует процессу накопления поврежденных белков в коллагене, что усугубляет ситуацию и негативно сказывается на механических свойствах тканей при старении (www.ncbi.nlm.nih.gov/pubmed/20308077).
В последние годы набирает популярность удаление стареющих клеток для будто омоложения. Но такая стратегия бесполезна для стареющего организма человека, потому что старый внеклеточный матрикс делает клетки старыми. И малополезно удалять старые клетки среди старых. И наоборот, взаимодействие старых клеток с молодым внеклеточным матриксом достаточно для омоложения стареющих клеток до явно молодого состояния.
 Мне на блог от читателей постоянно приходят вопросы про антиоксиданты, ресвератрол, сенесцентные клетки, теломеры и др. И все будто является секретом вечной молодости. Реклама так "накачивает" людей, что переубедить их потом уже ничем часто не представляется возможным.
Мне на блог от читателей постоянно приходят вопросы про антиоксиданты, ресвератрол, сенесцентные клетки, теломеры и др. И все будто является секретом вечной молодости. Реклама так "накачивает" людей, что переубедить их потом уже ничем часто не представляется возможным.
Хорошо известны вещества, которые умеют обезвреживать активные формы кислорода - антиоксиданты. Бум антиоксидантов пришелся на 60-70-е годы XX века. Но, как оказалось потом, антиоксиданты далеко не всегда способны остановить перекидное окисление липидов, а все клинические исследования на людях и доклинические исследования на животных не подтвердили, что антиоксиданты могут продлевать жизнь хотя бы у мышей дикого типа
www.ncbi.nlm.nih.gov/pmc/articles/PMC4036400
Не так давно закончился бум ресвератрола. Известный многим ресвератрол продлевал жизнь мухам дрозофилам, активируя ген SIRT1. Даже фармацевтический гигант Sirtris GlaxoSmithKline взялся за то, чтобы проверить ресвератрол на людях. Однако исследование было досрочно закончено из-за неэффективности и даже возможной опасности. Дочерняя компания Sirtris GlaxoSmithKline заявила, что досрочно прекратила свое клиническое испытание ресвератрола, которое не нашло никаких доказательств, что ресвератрол активировал ген SIRT1
- www.ncbi.nlm.nih.gov/pubmed/15328413
- https://singularityhub.com/2011/01/17/gsk-drops-resveratrol-could-the-embattled-supplement-live-on-in-other-forms
Также не так давно закончился бум теломеров. Спекулируя на модных темах, фармацевтический бизнес пытается продавать то, что будто замедляет старение. Так возник препарат ТА-65 — активатор теломеразы. Будто открыт секрет старения и заключается он в укорочение теломеров. И если удлинять теломеры с помощью фермента теломеразы, то будет вечная молодость и долгая жизнь. Но препарат ТА-65, активатор теломеразы, никак жизнь мышам не продлевал ни на один процент. Зато стоит он за месячный курс около 500-800 долларов. Хороший развод на деньги? (www.ncbi.nlm.nih.gov/pubmed/21426483)
С тех пор ничего не поменялось. В 2018 году был бум сенолитиков. Будто сенолитики, которые убивают стареющие клетки скоро смогут продлевать нам рекордно жизнь и заметно потеснить старение. Но, как и любой бум, вероятно и они скоро получат свой закат, как когда-то антиоксиданты. Как такие бумы начинаются, как проходят и почему - читайте в статье "Почему почти все БАДы, будто бы продлевающие жизнь, могут ее сократить или бесполезны"
Итак, остановимся подробнее на сенолитиках.
Что первично - яйцо или курица? Денис Одиноков, как-то писал в фейсбуке про то, как стареющий матрикс создает стареющие клетки (рекомендую его статью). Сенесцентные ли клетки старят человека? Либо стареющий внеклеточный матрикс создает чрезмерное накопление сенесцентных (стареющих) клеток? Если второе верно, то бесполезно бороться в организме со стареющими клетками. Так же, как бесполезно ловить дым из трубы, когда не дым порождает дым, а огонь в печени. Как стареющий матрикс вызывает сенесцентность?
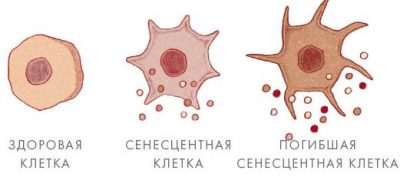 Взаимодействие с внеклеточным матриксом из молодых клеток достаточно для омоложения стареющих клеток до явно молодого состояния. Идентичность восстановленных клеток, полученных из стареющих клеток, была подтверждена различными методами, включая визуализацию живых клеток с временной задержкой и анализ ДНК. Помимо морфологии клеток, фенотипическое восстановление оценивали по возобновлению пролиферативного потенциала, реактивности факторов роста, снижению уровня внутриклеточных активных форм кислорода, восстановлению мембранного потенциала митохондрий и увеличению длины теломеров. Не было обнаружено экспрессии теломеразы в восстановленных клетках. Видимо восстановление теломеров может происходить по теломеразно-независимому механизму. Эти наблюдения показывают, что на старение клеток человека глубоко влияют сигналы от внеклеточного матрикса, и что пластичность стареющих клеток намного больше, чем считалось ранее. В будущих исследованиях будет интересно определить, могут ли эти восстановленные клетки, прожившие повторно до старения, быть восстановлены снова с помощью нового взаимодействия с молодым внеклеточным матрасом. Если да, то какие пределы (если таковые имеются) существуют для последовательного восстановления стареющих фибробластов снова и снова (www.ncbi.nlm.nih.gov/pubmed/21108727). В следующем исследовании старые стволовые клетки очень пожилого человека удалось омолодить, культивируя их на молодом внеклеточном матриксе (www.ncbi.nlm.nih.gov/pubmed/29078802). Другие авторы также говорят о влиянии внеклеточного матрикса на клеточное старение. Старение внеклеточного матрикса скелетных мышц приводит к фиброгенной конверсии стволовых клеток. Повышенная жесткость старого внеклеточного матрикса относительно молодых аналогов сопровождается ремоделированием цитоскелета и удлинением ядра в состаренных фибробластах. Почти три десятилетия назад Ингбер и его коллеги предположили, что судьбу клеток можно контролировать с помощью механических механизмов внутри ткани, что и было воспроизведено при моделировании в этом исследовании "Aging of the skeletal muscle extracellular matrix drives a stem cell fibrogenic conversion. Here, we investigated the direct effect of the aged muscle ECM on MuSC lineage specification. The increased stiffness of the aged ECM relative to young counterparts, as observed with biaxial testing (Fig 1), is concomitant with the cytoskeletal remodeling and nuclear elongation in the aged fibroblasts (Fig 2). Nearly three decades ago, Ingber and colleagues suggested that cell fate may be controlled via mechanical mechanisms within the tissue. More recently, using two‐dimensional culture systems in which substrate stiffness was engineered to mimic tissues with varying matrix rigidities, including brain, muscle, and bone, the fate of mesenchymal stem cells was powerfully modulated according to elastic characteristics of substrate upon which the cells were maintained. Exposure of human‐derived MuSCs to an aged myomatrix inhibited myogenicity and promoted a fibrogenic conversion of cells, when compared to cells seeded onto similarly prepared decellularized matrix constructs derived from young skeletal muscle" www.ncbi.nlm.nih.gov/pmc/articles/PMC5418187
Взаимодействие с внеклеточным матриксом из молодых клеток достаточно для омоложения стареющих клеток до явно молодого состояния. Идентичность восстановленных клеток, полученных из стареющих клеток, была подтверждена различными методами, включая визуализацию живых клеток с временной задержкой и анализ ДНК. Помимо морфологии клеток, фенотипическое восстановление оценивали по возобновлению пролиферативного потенциала, реактивности факторов роста, снижению уровня внутриклеточных активных форм кислорода, восстановлению мембранного потенциала митохондрий и увеличению длины теломеров. Не было обнаружено экспрессии теломеразы в восстановленных клетках. Видимо восстановление теломеров может происходить по теломеразно-независимому механизму. Эти наблюдения показывают, что на старение клеток человека глубоко влияют сигналы от внеклеточного матрикса, и что пластичность стареющих клеток намного больше, чем считалось ранее. В будущих исследованиях будет интересно определить, могут ли эти восстановленные клетки, прожившие повторно до старения, быть восстановлены снова с помощью нового взаимодействия с молодым внеклеточным матрасом. Если да, то какие пределы (если таковые имеются) существуют для последовательного восстановления стареющих фибробластов снова и снова (www.ncbi.nlm.nih.gov/pubmed/21108727). В следующем исследовании старые стволовые клетки очень пожилого человека удалось омолодить, культивируя их на молодом внеклеточном матриксе (www.ncbi.nlm.nih.gov/pubmed/29078802). Другие авторы также говорят о влиянии внеклеточного матрикса на клеточное старение. Старение внеклеточного матрикса скелетных мышц приводит к фиброгенной конверсии стволовых клеток. Повышенная жесткость старого внеклеточного матрикса относительно молодых аналогов сопровождается ремоделированием цитоскелета и удлинением ядра в состаренных фибробластах. Почти три десятилетия назад Ингбер и его коллеги предположили, что судьбу клеток можно контролировать с помощью механических механизмов внутри ткани, что и было воспроизведено при моделировании в этом исследовании "Aging of the skeletal muscle extracellular matrix drives a stem cell fibrogenic conversion. Here, we investigated the direct effect of the aged muscle ECM on MuSC lineage specification. The increased stiffness of the aged ECM relative to young counterparts, as observed with biaxial testing (Fig 1), is concomitant with the cytoskeletal remodeling and nuclear elongation in the aged fibroblasts (Fig 2). Nearly three decades ago, Ingber and colleagues suggested that cell fate may be controlled via mechanical mechanisms within the tissue. More recently, using two‐dimensional culture systems in which substrate stiffness was engineered to mimic tissues with varying matrix rigidities, including brain, muscle, and bone, the fate of mesenchymal stem cells was powerfully modulated according to elastic characteristics of substrate upon which the cells were maintained. Exposure of human‐derived MuSCs to an aged myomatrix inhibited myogenicity and promoted a fibrogenic conversion of cells, when compared to cells seeded onto similarly prepared decellularized matrix constructs derived from young skeletal muscle" www.ncbi.nlm.nih.gov/pmc/articles/PMC5418187
 А вообще нужно ли убивать сенесцентные клетки? Нужно ли затыкать дым в трубе, если горит печка? Если погасить печку, то дым сам собой прекратится. Но если попытаться заткнуть трубу, то могут погибнуть от угарного газа все, кто находится в доме, как минимум. Дело в том, что совсем непонятны последствия у людей при лечении сенолитиками, так как мы до конца не понимаем последствия такого лечения. И результаты могут быть разными. Так как сенесцентные клетки могут не только способствовать фиброзу, но и наоборот тормозить фиброз «Thus, we demonstrate that cellular senescence acts to limit the fibrogenic response to tissue damage, thereby establishing a role for the senescence program in pathophysiological settings beyond cancer.» «the senescence of activated HSCs provides a barrier that limits liver fibrosis.», а старение в некоторых ситуациях может представлять собой гомеостатический механизм, который позволяет ткани вернуться к своему предразрушенному состоянию «Thus, senescence represents a homeostatic mechanism that enables the tissue to return to its predamaged state.»
А вообще нужно ли убивать сенесцентные клетки? Нужно ли затыкать дым в трубе, если горит печка? Если погасить печку, то дым сам собой прекратится. Но если попытаться заткнуть трубу, то могут погибнуть от угарного газа все, кто находится в доме, как минимум. Дело в том, что совсем непонятны последствия у людей при лечении сенолитиками, так как мы до конца не понимаем последствия такого лечения. И результаты могут быть разными. Так как сенесцентные клетки могут не только способствовать фиброзу, но и наоборот тормозить фиброз «Thus, we demonstrate that cellular senescence acts to limit the fibrogenic response to tissue damage, thereby establishing a role for the senescence program in pathophysiological settings beyond cancer.» «the senescence of activated HSCs provides a barrier that limits liver fibrosis.», а старение в некоторых ситуациях может представлять собой гомеостатический механизм, который позволяет ткани вернуться к своему предразрушенному состоянию «Thus, senescence represents a homeostatic mechanism that enables the tissue to return to its predamaged state.»
- cell.com/cell/fulltext/S0092-8674(08)00836-2?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS0092867408008362%3Fshowall%3Dtrue
Вероятно, в будущем путем клинических исследований могут быть созданы протоколы, которые будут определять, когда целесообразна терапия сенолитиками, а когда нет. А пока на себе лучше не проверять. В настоящий момент известна и вредная и парадоксально полезная роль сенесцентных клеток в организме. И что перевесит и в какой ситуации с точки зрения долголетия — предстоит еще долго выяснять в исследованиях (www.ncbi.nlm.nih.gov/pubmed/29374361). Хваленный дазатиниб, как сенолитик, иногда просто приводит к снижению функциональной способности ткани, поскольку потеря сенесцентных клеток иногда не восполняется молодыми. "Rho-kinase inhibition ameliorates dasatinib-induced endothelial dysfunction and pulmonary hypertension" https://europepmc.org/abstract/pmc/pmc5962749 Точно также Pax7-экспрессирующие сателлитные клетки, которые образуются еще на стадии эмбриона, незаменимы для регенерации скелетных мышц у взрослых, и истощение их пула ведет к миопатии https://doi.org/10.1016/j.cell.2018.10.013
Если медицина и уровень жизни разных стран могут дать человеку дополнительные годы жизни в пределах 100 лет, то в самом старом возрасте мы наблюдаем одинаковый для всех людей предел долголетия на уровне 117 лет (рекорд). Без решения проблемы со старением внеклеточного матрикса и прочих долгоживущих протеинов - большинство биотехнологий омоложения могут увеличить только здоровый период жизни и немного продлить жизнь, но не позволят человеку жить более 117 лет. В настоящее время не существует в науке способа позволить человеку прожить более 117 лет. И даже это только рекорд. Все, на что мы можем рассчитывать - это 90-100 лет. Остальное могут предлагать только мошенники.
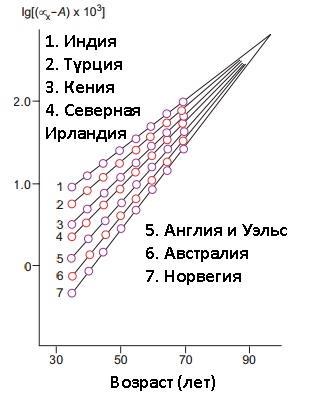 Без решения проблемы со старением внеклеточного матрикса и прочих долгоживущих протеинов - большинство биотехнологий омоложения могут увеличить healthspan, но не максимальную видовую продолжительность жизни человека. Так как основное старение у всех людей происходит примерно одинаково, несмотря на разные внешние его проявления, то мы все умрем не позже, чем до 117 лет, даже если до этого имеем разное здоровье, как имеют различное здоровье люди в разных странах (смотрите график слева). Но тем не менее во всех странах максимальная продолжительность жизни одинаковая. Мы видим на графике, что все кривые сходятся в одной точке на самом критическом возрасте. И не наблюдается такого, что если лучше здоровье в более развитых странах, то это приводило бы к удлинению максимальной продолжительность жизни. Напротив, если медицина и уровень жизни разных стран могут дать человеку дополнительные годы жизни, то в самом старом возрасте мы наблюдаем одинаковый для всех людей предел долголетия (ncbi.nlm.nih.gov/pubmed/12867663) (dx.doi.org.sci-hub.cc/10.1126/sageke.2003.28.re5)
Без решения проблемы со старением внеклеточного матрикса и прочих долгоживущих протеинов - большинство биотехнологий омоложения могут увеличить healthspan, но не максимальную видовую продолжительность жизни человека. Так как основное старение у всех людей происходит примерно одинаково, несмотря на разные внешние его проявления, то мы все умрем не позже, чем до 117 лет, даже если до этого имеем разное здоровье, как имеют различное здоровье люди в разных странах (смотрите график слева). Но тем не менее во всех странах максимальная продолжительность жизни одинаковая. Мы видим на графике, что все кривые сходятся в одной точке на самом критическом возрасте. И не наблюдается такого, что если лучше здоровье в более развитых странах, то это приводило бы к удлинению максимальной продолжительность жизни. Напротив, если медицина и уровень жизни разных стран могут дать человеку дополнительные годы жизни, то в самом старом возрасте мы наблюдаем одинаковый для всех людей предел долголетия (ncbi.nlm.nih.gov/pubmed/12867663) (dx.doi.org.sci-hub.cc/10.1126/sageke.2003.28.re5)
Взрослые стволовые клетки можно омолодить, выращивая их в молодом внеклеточном матриксе. И наоборот, если вы берете старый внеклеточный матрикс и помещаете в него молодые клетки, у них внезапно появляются признаки старения. Таким образом, внеклеточный матрикс - главный ограничитель продолжительности жизни человека и, возможно, основная причина старения человека.
 Когда дело доходит до болезни сердца, здоровье каркаса (внеклеточного матрикса), где растут сердечные клетки, может быть гораздо большим фактором, чем считалось ранее. Стюарт Кэмпбелл, адъюнкт-профессор биомедицинской инженерии, клеточной и молекулярной физиологии, возглавлял команду исследователей, изучавших влияние больного внеклеточного матрикса, который организует клетки в ткань, на поведение здоровых клеток сердца. Они выяснили, что это внеклеточный матрикс играет главную роль в прогрессировании гипертрофической кардиомиопатии сердца, а не сами клетки сердца. Гипертрофическая кардиомиопатия сердца часто обусловлена мутациями в генах. Медикаментозное лечение может исправить последствия этих мутаций, но не может полностью вылечить это заболевание. Подозревая, что виновником является нездоровый внеклеточный матрикс, команда Кэмпбелла впервые получила больной внеклеточный матрикс сердечной мышцы от модели свиньи с гипертрофической кардиомиопатией сердца. Клетки сердца были химически удалены из ткани (остался лишь внеклеточный матрикс) и заменены здоровыми клетками сердечной мышцы человека. К удивлению многих, здоровые клетки сердца, которые росли на здоровом внеклеточном матриксе, сделали здоровую сердечную ткань. Однако здоровые клетки сердца, которые росли на больном внеклеточном матриксе, произвели сердечную мышечную ткань с признаками гипертрофической кардиомиопатии. То есть полностью здоровые клетки ничего не дали, а здоровье сердца диктовал внеклеточный матрикс. Это действительно удивительно, потому что эти клетки содержат такую же генетику, и все же у них совершенно другое поведение, благодаря тому на каком внеклеточном матриксе они росли. Как будто больной внеклеточный матрикс помнит, что до этого он был частью нездорового сердца.
Когда дело доходит до болезни сердца, здоровье каркаса (внеклеточного матрикса), где растут сердечные клетки, может быть гораздо большим фактором, чем считалось ранее. Стюарт Кэмпбелл, адъюнкт-профессор биомедицинской инженерии, клеточной и молекулярной физиологии, возглавлял команду исследователей, изучавших влияние больного внеклеточного матрикса, который организует клетки в ткань, на поведение здоровых клеток сердца. Они выяснили, что это внеклеточный матрикс играет главную роль в прогрессировании гипертрофической кардиомиопатии сердца, а не сами клетки сердца. Гипертрофическая кардиомиопатия сердца часто обусловлена мутациями в генах. Медикаментозное лечение может исправить последствия этих мутаций, но не может полностью вылечить это заболевание. Подозревая, что виновником является нездоровый внеклеточный матрикс, команда Кэмпбелла впервые получила больной внеклеточный матрикс сердечной мышцы от модели свиньи с гипертрофической кардиомиопатией сердца. Клетки сердца были химически удалены из ткани (остался лишь внеклеточный матрикс) и заменены здоровыми клетками сердечной мышцы человека. К удивлению многих, здоровые клетки сердца, которые росли на здоровом внеклеточном матриксе, сделали здоровую сердечную ткань. Однако здоровые клетки сердца, которые росли на больном внеклеточном матриксе, произвели сердечную мышечную ткань с признаками гипертрофической кардиомиопатии. То есть полностью здоровые клетки ничего не дали, а здоровье сердца диктовал внеклеточный матрикс. Это действительно удивительно, потому что эти клетки содержат такую же генетику, и все же у них совершенно другое поведение, благодаря тому на каком внеклеточном матриксе они росли. Как будто больной внеклеточный матрикс помнит, что до этого он был частью нездорового сердца.
Для справки. Децеллюляризация — процедура очистки от клеточного компонента. Децеллюляризация тканей и органов для тканевой инженерии и регенеративной медицины широко применяется для создания каркасов кровеносных сосудов, клапанов сердца, сердца, перикарда, печени, легких, мочевых пузырей, тонкого кишечника, дермы, мышц, сухожилий и связок.
 Исследователи наблюдали что ткань на больном внеклеточном матриксе требовала в 2 раза больших усилий, чтобы растягиваться также - то есть была значительно более жесткой. Это, по словам Кэмпбелла, указывает на то, что жесткость самого больного внеклеточного матрикса перепрограммировало клетки для создания опять же больного сердца. Для того, чтобы противодействовать более жесткому внеклеточному матриксу, клетки растут более большими по размеру, возможно, повторяя сверхнормальный рост ткани сердца, который наблюдался при гипертрофической кардиомиопатии сердца. Что интересно, так это то, что если вы берете больной внеклеточный матрикс и помещаете в него здоровые клетки, у них внезапно появляются признаки пациента с плохой диастолой-фазой релаксации сердца "What’s fascinating is that if you take the diseased ECM and put some healthy cellson it, they suddenly have the hallmarks of the patient with poor diastole—the heart’s relaxation phase" Вот почему самостоятельно эпигенетический откат и стволовые клетки бесполезны для омоложения! Благодарю Дениса Варванца за предоставленную информацию.
Исследователи наблюдали что ткань на больном внеклеточном матриксе требовала в 2 раза больших усилий, чтобы растягиваться также - то есть была значительно более жесткой. Это, по словам Кэмпбелла, указывает на то, что жесткость самого больного внеклеточного матрикса перепрограммировало клетки для создания опять же больного сердца. Для того, чтобы противодействовать более жесткому внеклеточному матриксу, клетки растут более большими по размеру, возможно, повторяя сверхнормальный рост ткани сердца, который наблюдался при гипертрофической кардиомиопатии сердца. Что интересно, так это то, что если вы берете больной внеклеточный матрикс и помещаете в него здоровые клетки, у них внезапно появляются признаки пациента с плохой диастолой-фазой релаксации сердца "What’s fascinating is that if you take the diseased ECM and put some healthy cellson it, they suddenly have the hallmarks of the patient with poor diastole—the heart’s relaxation phase" Вот почему самостоятельно эпигенетический откат и стволовые клетки бесполезны для омоложения! Благодарю Дениса Варванца за предоставленную информацию.
- m.medicalxpress.com/news/2019-07-heart-cells-environment-potentially-major.html
- https://sci-hub.se/10.1016/j.jacbts.2019.03.004#
- www.sciencedirect.com/science/article/pii/S2452302X19300774?via%3Dihub
И еще ранее было уже известно, что взрослые стволовые клетки можно омолодить, выращивая их в молодой среде. Можно брать старые стволовые клетки от старых людей и выращивать их на молодом внеклеточном матриксе. В этом случае старые клетки опять омолаживаются, что также было подтверждено в 2014 году учеными из Университета Падуи, Италия (www.ncbi.nlm.nih.gov/pubmed/24418517). Интересно, что омолодить гемопоэтические стволовые клетки можно с помощью циклов голоданий. (www.ncbi.nlm.nih.gov/pubmed/25072352). Ключевая роль внеклеточного матрикса в регулировании поведения клеток — это уже устоявшийся факт, и эта концепция особенно важна для стволовых клеток, которые определяются уникальной и специализированной нишей, в которой внеклеточный матрикс играет важнейшую роль (www.ncbi.nlm.nih.gov/pubmed/16672370) (www.sciencedirect.com/science/article/pii/S0262407911622008)
Взрослые стволовые клетки можно омолодить, выращивая их в молодой среде — по крайней мере, у мышей по данным статьи, опубликованной в 2011 году в журнале NewScientist. Мезенхимальные стволовые клетки находятся в костном мозге у взрослых людей и могут дифференцироваться в различные типы клеток. Эти клетки имеют большой потенциал, но в целом их качество и количество уменьшается с возрастом. И вот Сяо-Дон Чэнь из Научного центра здоровья Техасского Университета в Сан-Антонио со своей командой взяла мезенхимальные стволовые клетки у 3-х месячных (молодых мышей) и у 18 месячных (старых мышей).
- Когда клетки и старых и молодых мышей пытались выращивать в старом внеклеточном матриксе, то старые оставались такими же, а молодые клетки старели — оба вида клеток показывали лишь 4,1 и 3,8 кратное расширение соответственно.
- Но когда клетки и старых и молодых мышей пытались выращивать в молодом внеклеточном матриксе, то старые клетки молодели — оба вида клеток показывали 16,1 и 17,1 кратное расширение соответственно.
- www.sciencedirect.com/science/article/pii/S0262407911622008
Когда начинается старение? Одна из гипотез предполагает, что старение начинается тогда, когда регенерация органов без образования шрамов становится невозможной. Сердце у однодневных мышат регенерирует идеально после среза кусочка сердца. А на второй день не регенерирует уже — только образовываются шрамы.
 В каком возрасте человек начинает стареть? Если вы погуглите в интернете, то увидите, что единого мнения нет. Вот примеры:
В каком возрасте человек начинает стареть? Если вы погуглите в интернете, то увидите, что единого мнения нет. Вот примеры:
- «И если один говорит, что старым человек становится в сорок, то второй считает, что его жизнь только начинается.»
- «Когда человек достигает 25-27 лет, рост останавливается и начинается процесс старения.»
- «Уже в возрасте около 20 лет начинается постепенное старение мозга. В возрасте от 30 до 40 лет начинают стареть мышцы, падает физическая выносливость. После 40 лет начинает происходить старение сердца. После 50 лет начинают стареть почки и желудок, ухудшается слух. исследования показали, что печень начинает стареть в возрасте около 70 лет»
- «Американские ученые высчитали возраст, с которого начинается старение человека. По мнению специалистов, старость приходит к человеку, когда в мозге начинает уменьшаться выработка миелина. Выяснилось, что пик выработки миелина и активности человека приходится на возраст 39 лет. После перехода этого возрастного рубежа в организме запускается процесс прекращения выработки миелина, и человек начинает стареть.»
- «Ученые пока даже не пришли к единому мнению, с какого возраста начинается старение организма.»
- «В древности человеческую жизнь делили на молодость и старость, причем началом старения считали 35 лет, по Гиппократу – 42 года»
- «уже в возрасте 25 лет резко проявляются первые признаки старения»
- «человеческий организм запускает процесс старения после 27 лет»
 Если считать старением тот момент, когда внеклеточный матрикс начинает становиться более жестким, то старение начинается почти с самого рождения. Помните нежную кожу и тело новорожденного малыша. Он настолько нежен, что его легко повредить. Центральное слово - "повредить". Почему? Читаем дальше.
Если считать старением тот момент, когда внеклеточный матрикс начинает становиться более жестким, то старение начинается почти с самого рождения. Помните нежную кожу и тело новорожденного малыша. Он настолько нежен, что его легко повредить. Центральное слово - "повредить". Почему? Читаем дальше.
Возрастные изменения во внеклеточном матриксе, которые проявляются в жесткости суставов, сосудистой системы и капилляров почек, а также сетчатки глаз происходят в первую очередь из-за межмолекулярного «сшивания» молекул коллагена внеклеточного матрикса. Формирование перекрестных «сшивок» было продемонстрировано Верзаром еще более 40 лет назад. Сейчас уже известно, что этот процесс включает в себя два различных механизма: один строго контролируется с помощью ферментов в процессе развития и созревания, и происходит с постоянной скоростью, а второй случайный неферментативный, который зависит от многих факторов. Именно второй неферментативный известен, как гликация, включающий реакцию с глюкозой и с последующими продуктами окисления — является основной причиной ускоренного старения и испорченного коллагена внеклеточного матрикса в пожилом возрасте. Второй процесс может также ускоряться у больных сахарным диабетом из-за более высокого уровня глюкозы в анализах крови. Если бы на нас воздействовал только первый процесс, то старение протекало бы несколько медленнее (www.ncbi.nlm.nih.gov/pubmed/9883973). Однако и первый процесс можно заблокировать теоретически с помощью фермента лизилоксидазы, который является катализатором конвертации молекул лизина в высоко реактивные альдегиды, участвующие в формировании поперечных сшивок во внеклеточном матриксе. Однако такая блокада хоть и замедлит модификацию матрикса, но теоретически может поставить жизнь под угрозу при любой травме и т.п.. Почему? Давайте рассмотрим пример.
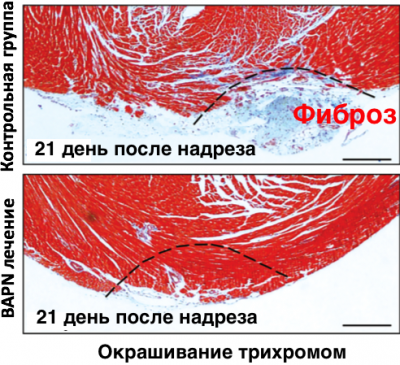
Когда начинается старение? Одна из гипотез предполагает, что старение начинается тогда, когда регенерация органов без образования шрамов становится невозможной. Все попытки омоложения стволовыми клетками пожилых людей потерпели крах или оказались малоэффективными. Но чем моложе организм, тем больше действие стволовых клеток. А у новорожденных, так вообще чудеса. Сердце у однодневных мышат регенерирует идеально после среза кусочка сердца. А на второй день не регенерирует уже — только образовываются шрамы. Это потому, что в первый день активно идет образование ферментативных сшивок, и быстро увеличивается жесткость внеклеточного матрикса. С помощью ингибитора активности лизилоксидазы (β-аминопропионитрила (BAPN) исследователи заблокировали фермент лизилоксидазу, который является катализатором конвертации молекул лизина в высоко реактивные альдегиды, участвующие в формировании поперечных сшивок во внеклеточном матриксе. И сердце осталось способным регенерировать еще долгое время. Образование шрама - это просто "заплатка" соединительной тканью. А регенерация - это когда клетки создают новый участок полноценной ткани. Этот процесс долгий. Есть гипотеза, что, вероятно, регенерация отключается у взрослого организма, так как взрослому животному нужно быстро, хоть и некачественно заживлять раны. Вероятно, регенерация отключается из-за увеличения жесткость матрикса у взрослого организма, так как от скорости восстановления ран зависит выживание. Ставить заплатки на сердце шрамами это допустимо, и это работает какое-то время. И для эволюции это хорошо - животное успевает дать потомство и сохранить вид. А потом эволюции все равно, что с нами будет (https://advances.sciencemag.org/content/4/5/eaao5553)
www.ibecbarcelona.eu/young-at-heart-novel-temporal-window-of-cardiac-regeneration/
Некоторые рыбы и амфибии сохраняют прочную способность к регенерации сердца на протяжении всей жизни, но то же самое не относится к сердцу взрослых млекопитающих. (www.ncbi.nlm.nih.gov/pubmed/21350179)(www.ncbi.nlm.nih.gov/pubmed/28198139)(www.ncbi.nlm.nih.gov/pubmed/30794778) (www.ncbi.nlm.nih.gov/pubmed/29966974). Сердце взрослого млекопитающего не способно регенерировать вследствие постмитотической природы клеток сердца. Однако, сердце новорожденной мыши может регенерировать. Дело в том, что в течение первой недели жизни меняется состав внеклеточного матрикса, что влияет на рост и дифференцировку кардиомиоцитов у мышей. Для полной регенерации сердец новорожденных необходим такой компонент внеклеточного матрикса, как агрин. Ин витро рекомбинантный агрин способствует делению кардиомиоцитов, которые получены из мышиных и человеческих индуцированных плюрипотентных стволовых клеток. Ин виво однократное введение агрина способствует регенерации сердца у взрослых мышей после инфаркта миокарда, хотя степень пролиферации кардиомиоцитов, наблюдаемая в этой модели, предполагает наличие дополнительных терапевтических механизмов. Регенеративный эффект агрина у взрослых мышей наступает через 3-5 недель после травмы, что было подтверждено двумя независимыми лабораториями (www.ncbi.nlm.nih.gov/pubmed/28581497).
А это показывал Саша Фединцев.
Еще один важнейший факт в пользу матриксной гипотезы: Lorenzo Magrassi, a neurosurgeon at the University of Pavia, thinks not. He recently transplanted neuron-making cells from mouse embryos into the developing brains of longer-lived rats. These cells matured into neurons that looked like mouse neurons… but with rat lifespans. They survived for up to 36 months, around twice as long as they normally do in their native mouse brains.
“Neurons do not have a fixed lifespan,” says Magrassi. “They may survive forever. It’s the body that contains them that die. If you put them in a longer-living body, they survive as long as the new body allows them to. It increases our hope that extending lifespan will not necessarily result in brain depleted of neurons.”
nationalgeographic.com/science/phenomena/2013/02/25/neurons-could-outlive-the-bodies-that-contain-them/
researchgate.net/publication/335174478_Niche_stiffness_underlies_the_ageing_of_central_nervous_system_progenitor_cells
Что это значит? Это прямо говорит о том, что функция клеток напрямую зависит от старения среды! Клетки могут по сути жить сколько угодно (как минимум, значительно больше типичной ПЖ вида)!
теперь попросту не может быть аргументов против матриксной гипотезы! Она ДОКАЗАНА
уже
клетки не имеют предела ПЖ, он задается средой и в бОльшей степени матриксом
Видимо раковые клетки теряют подчинение внешнему контролю и начинают вести себя как хотят - не в интересах организма и живут вечно. А организм - это когда каждая клетка свое место знает. И и эти клетки в организме организовал матрикс. А цена этой организации - старение. Так?
Выводы:
- Основная причина старения человека, вероятно, лежит в старении внеклеточного матрикса. Несмотря на то, что мы не умеем омолаживать матрикс человека, теперь мы лучше знаем, что такое старение. А значит имеем большие шансы победить его. Но для этого нужно правильно фокусировать научные усилия. В течение 100 лет с момента открытия старения внеклеточного матрикса, мы искали причину старения в клетке и не задумывались, что она может быть во внеклеточном матриксе. С тех пор было проведено много попыток омолодить клетки, но ни одной удачной попытки омолодить внеклеточный матрикс пожилого человека.
- Всю жизнь человека матрикс стареет - коллагеновые волокна сшиваются. Но пока человек растет, концентрация "сшивок" разбавляется. Когда организм перестает расти, концентрация сшивок увеличивается, а матрикс становится все более жестким. Сшивки делают неэластичными сердце, сосуды и т.п. Когда отвердение тканей из-за "сшивок" в матриксе достигает угрожающих жизни масштабов, человек умирает от старости. В этот момент омоложение клеток уже не спасет жизнь человека - это предел.
- Старый матрикс заставляет наши клетки стареть. А молодой матрикс может омолодить старые клетки до молодого состояния.
- Эволюция научилась обходить старение матрикса простым способом. Одна из клеток создает нового ребенка, организм которого отстраивает для себя новый матрикс с нуля. А бессмертные планарии все время растут и делятся, концентрация их "сшивок" разбавляется по мере роста животных. Это не значит, что устранить повреждения матрикса невозможно. Научиться омолаживать матрикс - это задача на следующие 20-30 лет, а может быть и на весь 21 век.
- Внеклеточный матрикс окружает клетки организма и передает им команды, через специальные рецепторы, диктуя их судьбу. С возрастом внеклеточный матрикс становится более жестким из-за кальцификации, накопления поперечных сшивок, удаления гликозаминогликанов и др. Повышенное сшивание коллагена с возрастом, превращает молодые клетки в старые, вызывает атеросклероз сосудов, способствует прогрессированию опухоли.
- В стареющем матриксе полное разрушение старого коллагена для обновления матрикса осуществляет катепсин К (CatK). Однако CatK не работает с удаленными гликозаминогликанами (GAGs), которые удаляются в процессе старения. Недоразрушенные участки накапливаются, повышая жесткость органов и тканей, что в итоге приводит к смерти. Также в молодом организме протеолитические ферменты не дают накапливаться рацемированным белкам. Однако, в тканях с замедленным метаболизмом из-за старения, количество рацемированных белков увеличивается. А поперечные сшивки коллагенов внеклеточного матрикса затрудняют доступ исправляющих ферментов к структурно измененным в результате рацемизации белкам, что также мешает заменять старые участки внеклеточного матрикса.
- В последние годы набирает популярность удаление стареющих клеток для будто омоложения. Но такая стратегия бесполезна для стареющего организма человека, потому что старый внеклеточный матрикс делает клетки старыми. И малополезно удалять старые клетки среди старых. И наоборот, взаимодействие старых клеток с молодым внеклеточным матриксом достаточно для омоложения стареющих клеток до явно молодого состояния.
- Если медицина и уровень жизни разных стран могут дать человеку дополнительные годы жизни в пределах 100 лет, то в самом старом возрасте мы наблюдаем одинаковый для всех людей предел долголетия на уровне 117 лет (рекорд). Без решения проблемы со старением внеклеточного матрикса и прочих долгоживущих протеинов - большинство биотехнологий омоложения могут увеличить только здоровый период жизни и немного продлить жизнь, но не позволят человеку жить более 117 лет. В настоящее время не существует в науке способа позволить человеку прожить более 117 лет. И даже это только рекорд. Все, на что мы можем рассчитывать - это 90-100 лет. Остальное могут предлагать только мошенники.
- Когда начинается старение? Одна из гипотез предполагает, что старение начинается тогда, когда регенерация органов без образования шрамов становится невозможной. Сердце у однодневных мышат регенерирует идеально после среза кусочка сердца. А на второй день не регенерирует уже — только образовываются шрамы.
- Уже сегодня известны некоторые витамины, БАДы, лекарства и факторы образа жизни, способные замедлять различные виды модификаций внеклеточного матрикса. Для полного обновления внеклеточного матрикса с целью настоящего омоложения человека, ученые должны научиться разбивать устойчивые поперечные сшивки коллагена. Но это, пока будущее.
- Возрастные изменение внеклеточного матрикса из-за кальция могут замедлять магний, витамин К2 (МК-7), аэробная физическая нагрузка.
- Возрастные изменение внеклеточного матрикса из-за чрезмерного его разрушения могут замедлять доксициклин, метформин, аэробная физическая нагрузка.
- Возрастные изменение внеклеточного матрикса из-за накопления сшивок в результате неферментативного гликирования могут замедлять сульфорафан из капусты брокколи, телмисартан, аэробная физическая нагрузка, диета OL.
- Возрастные изменение внеклеточного матрикса из-за фиброза могут замедлять пентоксифиллин, телмисартан, таурин, магний, аэробная физическая нагрузка,
- Возрастные изменение внеклеточного матрикса из-за ферментативного гликирования может замедлять ингибиторы активности лизилоксидазы, например, β-аминопропионитрила (BAPN). Но как их применять - пока непонятно.
- Для полного омоложения внеклеточного матрикса с целью настоящего омоложения человека, а не мошенничества, ученые должны научить разбивать устойчивые поперечные сшивки коллагена. Но это, пока будущее.
- Однако нельзя все это применять все и сразу. Разные причины, разные средства. Стратегия и тактика замедления модификации внеклеточного матрикса перечисленными средствами, изложена в ссылке. Однако она требует совместной работы с врачами, преподавателями по физической культуре. Самостоятельное лечение скорее всего навредит.
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить.
 Автор статьи — Веремеенко Дмитрий Евгеньевич, основатель исследовательского проекта, изучающего терапии, направленные на увеличение продолжительности жизни человека "Лаборатория Экспертных Исследований Тераностика_про" (nestarenie.ru/slb-expert_.html), создатель экспертной системы Тераностика_про, основатель Nestarenie Camp (https://nestareniecamp.ru), со-основатель on-line курса Nestarenie, автор книги "Диагностика старения" (https://nestarenie.ru/Diagnostika.pdf), и со-автор книги "Как дожить до 22 века" (http://book.hostenko.com), создатель блога https://nestarenie.ru, Тел. +7 925 9244328 Dmitriy-tae@yandex.ru
Автор статьи — Веремеенко Дмитрий Евгеньевич, основатель исследовательского проекта, изучающего терапии, направленные на увеличение продолжительности жизни человека "Лаборатория Экспертных Исследований Тераностика_про" (nestarenie.ru/slb-expert_.html), создатель экспертной системы Тераностика_про, основатель Nestarenie Camp (https://nestareniecamp.ru), со-основатель on-line курса Nestarenie, автор книги "Диагностика старения" (https://nestarenie.ru/Diagnostika.pdf), и со-автор книги "Как дожить до 22 века" (http://book.hostenko.com), создатель блога https://nestarenie.ru, Тел. +7 925 9244328 Dmitriy-tae@yandex.ru
Группа nestarenieRU в Facebook www.facebook.com/groups/nestarenie
Мой аккаунт в Facebook: https://www.facebook.com/nestarenieRU
YouTube-канал https://www.youtube.com/c/nestarenieRU
Знаете ли вы, что сайт nestarenie.ru — объективно один из самых популярных в России ресурсов про старение и долголетие - в Яндексе, в Гугле, по количеству, качеству и лояльности аудитории. nestarenie.ru имеет потенциал, чтобы стать одним из самых популярных сайтов о борьбе со старением не только в России, но и в мире. Для этого нужны деньги. Я призываю всех сделать пожертвования, а также убедить своих друзей поступить аналогично.
-
-
- Карта Viza (доллары): 4215 8901 1587 0138 для переводов за пределами РФ
- Карта МИР в Сбере (рубли): 2202 2032 1501 6686 (МАЙЯВИ Ч.) - на территории РФ
-
Узнайте подробнее помочь развитию блога.
Обязательно оставляйте свои комментарии под статьей, которую Вы читаете. Это очень важно для нас.
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить. Обязательно оставляйте свои комментарии под статьей, которую вычитаете. Это очень важно для нас.

Автор статьи
Веремеенко Дмитрий Евгеньевич
Телефон:
Почта:
Сфера деятельности - data science в медицине
Основатель проекта, изучающего терапии, направленные на увеличение продолжительности жизни человека (nestarenie.ru/slb-expert_.html)
Со-основатель IT сервиса продления жизни
Основатель форума о продлении жизни Nestarenie Camp (nestarenie.ru/camp.html)
Со-автор книги "Бонусные годы" (nestarenie.ru/kniga-3.html)
Создатель справочного блога о старении человека (nestarenie.ru)
Социальные сети:
- Карта Viza (доллары): 4215 8901 1587 0138 для переводов за пределами РФ
- Карта МИР в Сбере (рубли): 2202 2032 1501 6686 (МАЙЯВИ Ч.) - на территории РФ
Свежие комментарии
Подпишитесь на свежие статьи
Предлагаем Вам оформить почтовую подписку на самые новые и актуальные новости, которые появляются в науке, а также новости нашей научно-просветительской группы, чтобы ничего не упустить.

196 комментариев
А в Сургуте занимается кто нибудь биотехнологию омоложения
А антитела, есть резон применить к стимуляции эластина
А где можно посмотреть как сшивки влияют на работу ДНК и могут ли при этом образоваться ДНК триплексы, ДНК квадруплексы
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Как такие свойства матрикса, как эластичность и жесткость влияют на работу ДНК
https://youtu.be/HTcakn_bsK4
А есть какая нибудь статья или учебник как онивлияют на гены
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Внеклеточный матрикс (ВКМ) является важной особенностью тканей тела. Эта сложная бесклеточная структура состоит из сотен отдельных молекул, сборка, архитектура и биомеханические свойства которых имеют решающее значение для управления поведением и фенотипом различных типов клеток, находящихся в тканях. Клетки – это основная единица жизни и основной строительный блок тканей и органов. В простейшем случае они следуют набору правил, управляемых их генетическим кодом и осуществляемых через сложные белковые сигнальные сети, которые эти гены кодируют. Однако эти сигнальные сети обрабатывают и информацию, полученную клеткой извне. ВКМ является крупнейшим источником внешних стимулов для клеток и отвечает за динамику внутриклеточных сигналов. Он играет фундаментальную роль в регулировании клеточной активности через активацию или подавление внутриклеточных сигнальных путей. Нарушение регуляции гомеостаза ВКМ приводит к измененным программам передачи сигналов, и тем самым создает петлю прямой связи, которая может стимулировать развитие заболеваний, таких как хронические дегенеративные и аутоиммунные заболевания, фиброз и злокачественные новообразования. Компоненты ВКМ служат активаторами для рецепторов на клеточной поверхности, которые запускают сигнальные каскады. Если произвести полное удаление их всех, клетка самоуничтожается. Ключевыми рецепторами, взаимодействующими с внеклеточным матриксом, являются механо-чувствительные интегрины.
Они участвуют в межклеточных взаимодействиях и заживлении ран, а также в дегенеративных заболеваниях хрящевой ткани, фиброзе и раке. На внутриклеточную сигнализацию влияют такие факторы как: количество компонентов ВКМ, соотношение разных компонентов, жесткость матрикса (в результате перекрестных сшивок). Сигналы натяжения от ВКМ передаются на мембранные белки интегрины, которые активируют каскад фосфорилирования через киназы, которые опосредуют деление клеток, их дифференцировку и миграцию посредством регуляции транскрипции генов. Факторы транскрипции генов управляют экспрессией генов. То есть решают как гены будут работать.
bpspubs.onlinelibrary.wiley.com/doi/full/10.1111/bph.14195
гистологию нужно изучать для матрикса
У них есть заинтересованность? Или может нужна мотивация для того что бы собраться? Ведь короновирус это задача в краткосрочном периоде, придумали лекарство, пустили в производство, и все по клиникам и аптекам разошлось как средство от гриппа, мы же предлагаем собраться для решения более интересной и перспективной проблемы с большим объемом целевых потребителей.
Год назад на своём вебинаре Тераностика_про старения •25 янв. 2019 г. вы в конце говорили что планируется собрать всемирную конференцию врачей по тематике старения матрикса, это мероприятие будет?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Было бы, если бы не вирус. Сейчас все планы у всех изменились
Тут уже началась борьба с глюкозепаном, вот начало можно здесь почитать agefactor.com.ua/est-nadezhda-pobedit-glyukozepan/, Дмитрий вам что нибудь известно об этих исследованиях?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Да. Известно. Но это фермент. Он не пройдет через фибриллы коллагеновые. Это бесполезная технология.
Что можно сказать по хебуловой кислоте?
researchgate.net/publication/261838438_Effects_of_Chebulic_Acid_on_Advanced_Glycation_Endproducts-Induced_Collagen_Cross-Links
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Тут речь про сшивки Glycol-BSA-induced. Glycol-BSA-induced легко разрушается и его очень очень мало
А нам нужно разрушать глюкозепан, который не разрушается и его 80% всех сшивок у старых
Спасибо за грандиозный объем проделанной работы! Если выявлены все участники процесса и их роли в старении то что необходимо для того что бы найти решение по изменению процесса в благоприятную для нас сторону? Есть ли первоочередные задачи или приоритетность в этом направлении, или тут все комплексно решается, или экспериментальным путем?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Найти маленьку молекулу разбивающую глюкозепан
В чем разница между мышью, которая живет 2 года в среднем, и слоном, который живет несколько десятков лет? Черепахой, живет сотни лет? Бессмертной гидрой? Разница в генетике, то есть в некоей программе, которая управляет развитием конкретного организма. Ведь все остальное на клеточном уровне в принципе у всех одинаково, опуская мелкие нюансы… Тогда почему мы ищем различные препараты, продлляющие жизнь и улучшающие ее качество, приемы, вместо того чтобы фокусироваться на генетике? Нет понятно, дело это (поиски препаратов) нужное и полезное, честь и хвала людям (и вам лично Дмитрий), которые их открывют и популяризируют, но корневая то проблема не здесь, это же очевидно… Я уверен что не открываю америк своим постом и все это 300 раз уже разжевано где то на сайте наверняка, простите заранее) но вот если бы понять как работает эта программа, то следующим шагом было бы возможно ее отредактировать или даже обратить вспять…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Нет программы старения.
Чем отличается мышь и слон? Характером модификаций коллагеновых волокон матрикса прежде всего. Так у мышей жизнь короткая, и глюкосепан не успевает копиться. Но у них пентозидин и др. Его и нужно разрушать. Долгоживущие животные научились справляться с пентозидином, и карбоксиметиллизин для них не проблема, как для короткоживущих. А вот глюкосепан за долгую жизнь успевает накопиться и сшить коллаген необратимо. И долгодивущим нужны разрушатели глюкосепана. То, что продлевает мышам жизнь – это то, что задерживает накопление пентозидина и карбоксиметиллизина. Для долгодивущих это не актуально.
Дмитрий … ну так он и говорит надо с помощью генной инженерии внедрить программу разрушающую этот глюкосепан и добавляющую прочее полезное .. без этого ну продлим до максимума возможного то что есть (а кто то и сократит не всем подходят общие рекомендации) .. а дальше что? ничего .. я за генную инженерию .. за искусственный интеллект для разработки идеальной генетической программы , самовосстанавливающейся и адаптирующейся ..
Дмитрий, а может иметь смысл исследовать животных с быстрым оборотом внеклеточного матрикса без образования фиброза с целью изучения механизмов и может быть переноса их на человека? Есть такие животные среди тех, которые не растут всю жизнь? Я так поняла, что помимо расшивания матрикса ускорение безфиброзного оборота матрикса может существенно помочь замедлить или вообще остановить накопление сшивок.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Среди таких животных – человек самый самый? Человек аномально долго живет для своих размеров. Так, что уже и изучать некого.
А как же простая гидра? Они вроде как бессмертны именно за счет скорости обновления тканей и количества стволовых клеток. И увеличение количества матрикса за счет деления тут не при чем – если очень внимательно посмотреть видео делений, то станет видно, что новая гидра появляется сбоку и растит свой собственный матрикс, а не оттяпывет кусок старого у материнской гидры (практически как у людей или млекопитающих вообще). То есть у гидр по сути не деление матрикса, а наращивание нового сбоку для размножения. А первоначальная гидра может жить тысячи лет и оборот своего матрикса поддерживает не размножением.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Гидра ни живет тысячи лет. Гидра живет долго не изза стволовых клеток, а изза обновления матрикса.
1. Разве биологическое бессмертие гидры не считается доказанным? В смысле не увеличения вероятности смерти с возрастом (если не сожрет хищник)? Википедия ссылается на какое-то четырехлетнее исследование, где вероятность смерти гидр не повышалась с возрастом, но само исследование найти не могу. Отсюда смелое заявление про потенциальную возможность прожить тысячи лет, так как гидра не стареет.
2. В том и дело, что матрикс гидры быстро обновляется и обеспечивает ей нестарение, но очень похоже, что не за счет размножения он быстро обновляется. То есть не просто быстрым ростом и делением пополам, есть какие-то механизмы быстрого организованного уничтожения старого матрикса видимо и быстрой замены на новый без ухудшения его качества. Если посмотреть как гидра размножается – там матрикс новой гидры не из старой берется, а независимо сбоку нарастает, биологи это называют почкованием, хотя термин сути не объясняет. https://www.youtube.com/watch?v=vwm2tkHm47U Новая гидра может появиться методом регенерации из кусочка старой, но это именно исключение, а не основной способ размножения. Что вы об это думаете?
3. Насчет стволовых клеток согласна, скорее всего их повышенное количество просто следствие отличного матрикса. Но это не значит, что они не фасилитируют нестарение гидры, просто они берутся сами собой, когда матрикс безупречен.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
1. Нет. Гидра не бессмертна. Гидры не могут жить тысячи лет. Они могут какое-то количество поколений не размножаться половым путем. Но потом все равно они в какой-то момент начинают размножаться половым путем. И они очень часто гибнут. Их средняя продолжительность жизни очень маленькая. Просто они не от старения умирают. Вообще бессмертия не бывает.
Что такое старение – это рост вероятности умереть с возрастом. Но если не стареть, все равно все те же болезни настигают, но реже. Поэтому продолжительность жизни выше. Но это не бессмертие. Так человек нестареющий теоретически может жить 1000 лет. Но это не бессмертие
2. Гидры не могут бесконечное размножаться половым путем. Хотя отдельные виды гидра могут быть в течение целого ряда поколений быть бесполыми, но рано или поздно они опять начинают размножать половым путем.
АПД: я имела ввиду, что гидре скорее всего обеспечивает бессмертие скорость обновления матрикса (но не за счет разбавления новым, то есть без увеличения объемов матрикса, а именно с разрушением старого), а не разбивание сшивок (хотя кто знает, может и такие механизмы есть). И изучать есть что, потому что человеку оно тоже помогло бы (если без фиброза, обновлять на матрикс хорошего качества, но быстрее, чем обычно). Где-то в комментариях в статьях кто-то уже писал, что все выглядит так, что достаточно ускорить обновление матрикса человека процентов на 5% и уже начнется обгон накопления сшивок.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Гида имеет матрикс, как у новорожденной мыши. У мышат если надрезать сердце, то оно регенерирует. А вот уже через пару недель – только шрамы остаются. Но это слишком уязвимый матрикс. Гидре все равно. Ее хоть изречь на части, она будет жить в виде кучи новых гидр. А нам не все равно. Такой слабый матрикс не даст нам выжить. Нужно понимать, что гидры хоть не стареют. Но у них очень высокий риск повреждения и гибели не от старения.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Переделать все важные дела за один день – значит не сделать ничего. Именно поэтому мы планируем свой день, чтобы успеть сделать только самое-самое важное.
Аналогично, чтобы сделать лекарство от старения, нужно сначала понять, что накапливать и систематизировать всю информацию, которая только есть о механизмах старения – трата времени, которая не позволит нам успеть найти лекарство от старения в течение нашей ограниченной жизни.
У всех механизмов разная клиническая значимость. Вклад большинства известных механизмов старения на столько мал, что эффект на продолжительность жизни и на здоровье практически отсутствует – клинически не значим.
Нужно научиться выбирать и изучать только клинически значимые механизмы старения. Тогда у нас будет шанс успеть.
Иначе в этом мусоре информации мы утонем и ничего не успеем сделать за время нашей очень коротенькой жизни.
Шпигель уже где-то рядом
lifespan.io/news/revel-pharma-to-develop-glucosepane-breakers/
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Он делает фермент. А Фермент слишком большая молекула – не вариант
Доставлять неудобно?
ncbi.nlm.nih.gov/pubmed/30099344
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
К чему это?
Есть информация, что розмариновая кислота способна разбивать сшивки (более точной иформации дать не могу, возможно вы сможете что-то найти)
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
У людей нужно глюкосепановую сшивку разбивать. Ее ничто не разбивает
Нежность – ощущение чудесное , но строгая действительность вынуждает нас совладать в то , что одной радости для радостного развода слишком . Решившись на такой первостепенный полушаг , как помолвка , нужно суметь методологически оценить обоснованность своего ҏешения .
Дмитрий, вы немножко пугаете ЗОЖ ем. Это правильно, но и про рак и сосуды важно не забывать. Без лекарств никак. Продолжайте и о них писать пожалуйста
Дмитрий, можно попробовать омолаживать клетки и отключить в них послушание матриксу. В раковых клетках так и происходит. Тогда будет омоложение человека.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Тогда все клетки будут жить сами по себе, как и раковые. И не будет организма. Организм в единую систему строит матрикс.
вот статья в которой говорится что удаление синтезирующих энергию митохондрий из клеток устраняет проявления их старения
nplus1.ru/news/2016/02/04/senescence-mitophagy
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Стаоение клеток, или организма. Клетки могут жить дольше, чем органищм и не стареть. Проблема в том, что организм это не клеткич а клетки и внеклеточная среда. И вот именно эта среда драйвер старения. Омоложить клетки легко. Достаточно посадить стволовые клетки в молодую внеклеточную среду, и они сами собой омолодятся. И достаточно модолые клетки посадить в старую среду, и они быстро станут старыми. И как вы понимаете, омоложенные клетки, которые посадят в ваш организм тут же состарятся. А в вашем организме, если вы уже старый будете, их омоложить не смогут, так как внешняя среда будет через механорецепторы диктовать им быть старыми. Поэтому любые исследования, где омолаживают клетки не стоит воспринимать всерьез. И только омоложение все организма
витамин К2 (менахинон) является компонентом электроно-транспотрной цепи в митохондрии и может быть поэтому при его употреблений улучшается состояние организма?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Нет. Механизм витамина к2 доказан. Он карбоксилирует анкарбоксилированный матричный гла белок, что снижает уровень отложения кальцинатов
тогда скажите, повлияет ли употребление К2 на камни (калценаты) в предстательной железе?
Что вы думаете по поводу теорий митохондриального старения? что причино старения явлется некоректная работа митохондрий.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Если вы будете заниматься физической культурой и бегать, то все нормально у вас будет с митохондриями, но вы все равно будете стареть. А когда уже очень состаритесь, то и митохондрии начнут деградировать. Это не мричина старения. Старение это повышение жесткости внеклеточного окружения в результате сшивания коллагена
что вы думаете об этом исследовании, где говорится что митохондрии являются ключевыми факторами в развитии возрастных признаков старения embopress.org/doi/full/10.15252/embj.201592862
вы не считаете что нарушение клеточного дыхания приводящее к дисфункции митохондрии может быть причиной старения?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Старение человека начинается в юностич когла с митохондриями нет проблем. Т если бы митохондрия была причиной старения, то бег трусцой, при котором улучшается состояние метохондрий, омолаживал бы организм. Но этого не происходит. А пересадка митохондрий на животных, давала только чуть чуть пожить дольше.
Тогда скажите почему большое количество долгожителей живет в высокогорной местности? это разве не доказательство что пониженный уровень прциального давления кислорода приводит к меньшему повреждению митохондрии и продлевает жизнь, кстатии снижение уровня глюкозы тоже должно плодотворно влиять на продолжительность жизни так как через электроно-транспортную цепь протекает меньше электронов от гдюкозы к кислороду.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Это ваша гипотеза. А вот исследованияч которые изучали именно те местности в высокогорье, где долго живут показали, что изза удалентя от цивилизации у них питание с низкой гликемической нагрузкой, больше физической нагрузки.
можно ссылку на это исследование и второй вопрос следуя вашим словам получается что все те кто живут далеко от цивилизации долгожители? так же вы говорите что этому способствует снижение уровня глюкозы но в люди живущие в высокогорных местах не придерживаются каких либо правил в еде и наверно в оснвоном едят мясо, хлеб и т.д.
Здравствуйте, Дмитрий.
Ацетилсаллициловая кислота уже не входит в список продлевающих жизнь препаратов?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Нет
Процесс гликации ведь влияет не только на коллагеновые сшивки. На процесс слипания эритроцитов, повреждение нервных клеток, практически на все процессы в организме.
Надо найти способ предотвратить процесс гликации или обратить его вспять. Или хотя бы замедлить.
Используем же мы антиоксиданты, чтобы предотвратить окисление.
Дмитрий, а почему Вы не рассказываете о значении качества питьевой воды для продления жизни и омоложения? Ведь вода не менее важна, чем лекарственные препараты. Что Вы думаете о преимуществах структурированной воды по сравнению с обычной?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Так как по вожже нет доказательств
. Когда человек здоров, то MMPs малоактивны. Но когда происходит регенерация тканей, ремоделирование органа, воспалительный процесс, некоторые заболевания, то активность MMPs возрастает.
получается, что ингибиторы MMP (доксициклин) будут замедлять заживления ран и порезов?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Возможно
Возможно такие соединения можно удаленно разбивать излучением нужной длинны. Их ведь нельзя просто изять из организма. Но для этого, насколько я знаю, нужна математика, которая не готова. Или сажать толпу народа искать эмпирически. Но боюсь быстрее сначала поменять строй на что-то более оптимальное для занятий наукой, чем найти средства на такую мега-задачу в нынешнем обществе….
habr.com/ru/post/408157/
Как то так
Mожет подойдет метод из терапии рака?
Создается молекула, которая связыватся с глюкозепаном… но сама по себе его не разрушает.
Далее, такая связка при облучении определенными длинами волн поглощала бы энергию, что разрушало бы глюкозепан.
Дмитрий! Ранее вы писали о том, что витамин В6 тоже препятствует гликированию белков. А в данной статье он не упоминается. Появились сомнения в его пользе для матрикса?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Нужно то, что влияет именно на глюкосепан
Стало быть глюкозамин в данном случае тоже бесполезен?
Почему бы не запустить программу по поиску агента, который мог бы разрушить глюкозепановые сшивки на базе какого либо российского университета? Что этому мешает?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
То, что все упираются и не хотят этим заниматься – не хайп
Региональные университеты не жируют. При наличии определённого целевого гранта какая-либо команда вполне могла бы взяться за подобные исследования
Спасибо, отличная работа!!!
Дмитрий, Вы писали ранее, что пока что невозможно омоложение внеклеточного матрикса, а следовательно и увеличение максимальной продолжительности жизни. Но вы сказали, что возможно улучшение качества жизни и сохранения лучшего здоровья на более длительный промежуток времени. Подскажите пожалуйста, какие есть основные способы улучшить здоровье и качество жизни и отсрочить болезни старости на более поздний срок?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Все здесь
https://nestarenie.ru/denezhnye-rasxody-na-antistarenie.html
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
в старых мышах увеличивается кпг пентозидин
ncbi.nlm.nih.gov/pubmed/17901242
Глюкосепан – основная сшивка матрикса у людей (больше 50% от всех видов сшивок), глюкосепан начинает образовываться с лизина под действием глюкозы и заканчивает своё образование аргинином.
Гипотетически, чтобы медленнее образовывался глюкосепан – нужно с 18 лет ограничить поступление с пищей этих трёх компонентов: лизина, аргинина и всего, что повышает глюкозу больше определённого уровня.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Ограничение их употребления ничего не даст ни на один %, а вот жизнь сократит
Дмитрий, скажите пожалуйста, а стоит ли принимать для профилактики фиброза протеолитические ферменты? На IHERB продаются, Enzyme Defense и другие?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Профилактики в таблетках не существует ни против чего. А любой препарат, которого нет на жатом блоге, принимать не нужно.
Ну да, конечно, не для профилактики, а для уменьшения проявлений уже существующего фиброза. Ведь вы пишете в статье, что с возрастом снижается количество протеолитических ферментов, логично предположить, что их прием может заменить действие своих ферментов ….
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Фиброз в каком органе. Если в кровеносных сосудах, то это телмисартан, пентоксифиллин, здоровый образ жизни.
Дмитрий , также интересуюсь этим вопросом, гиперкератоз слизистой чем можно остановить?
Дмитрий, а если линейный фиброз легких после перенесённого воспаления- чем его можно уменьшить?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Можно замедлить прогрессирование еще больше. Но назад не вернуть
Дмитрий, так если линейный фиброз в легких, то чем замедлить прогрессирование? Вышеуказанными препаратами?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
да, если мы говорим об одном и том же.
Дмитрий. Как сочетается обновление клетки в молодом матриксе и предел Хейфлика в клеточной культуре в пробирке?
1. Правильно я понимаю, что в пробирке матрикса нет, тем не менее, предел Хейфлик есть. Тогда что даст омоложение матрикса в у человека, если клетка перестанет делиться?
2. Мутации ведь все одно накапливаются в клетке и от обновления матрикса в организме человека по идее никуда не должны деваться т.е. если клетка стала онкогенной, то это никуда не денется и предел Хейфлика защищает организм от такой клетки. Или же после обновления матрикса предел Хейфлика обнуляется и организме начинают катастрофически накапливаться такие онкогенные клетки. Раньше они умирали или становились зомби, а теперь они клетки накопившие мутаций продолжат свою жизнь?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Стволовые клетки не имеют предела деления. А новые клетки образуются из них.
Мутации в стволовых неспециализированных клетках не особо накапливаются. А если они становятся раковыми, то самоуничтожаются
>Стволовые клетки не имеют предела деления. А новые клетки образуются из них.
Мутации в стволовых неспециализированных клетках не особо накапливаются. А если они становятся раковыми, то самоуничтожаются
Дмитрий, а почему тогда так много случаев онкогенеза после использования для омоложения стволовых клеток?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Потому, что используют не плюрипотентные а мезенхемальные. И еще потому, что опухоли хорошо растут в твердых средах. А наш матрикс стареет, нужно пересаживать костный мозг, который вместе со стволовой нишей, а не отдни клетки
youtu.be/gfKjLlD_FPg
Вот вышло новое исследование
lenta.ru/news/2019/08/15/aging/?utm_referrer=https%3A%2F%2Fzen.yandex.com
показывающее важное влияние жесткости матрикса на стволовые клетки в мозге…они реагируют на жесткость матрикса вырабатывая белок Piezo1, который является сигналом к прекращению регенеративной способности стволовых клеток и они прекращают обновлять ткань…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
“Стволовые клетки, полученные из мозга старых крыс, в лаборатории размножались гораздо хуже, чем клетки молодых животных. Однако эти свойства терялись, если ученые пересаживали их в организм животного другого возраста: «юные» клетки переставали делиться в старой ткани, а к «пожилым» клеткам, напротив, возвращалась молодость, когда их вводили в мозг новорожденного крысенка.
Чтобы проверить, действительно ли дело во внеклеточном матриксе, ученые решили его размягчить. Для этого они частично «переваривали» жесткие межклеточные волокна с помощью фермента хондроитиназы, а затем повреждали участок ткани, чтобы запустить регенерацию. У крыс с «размягченным» мозгом травмы заживали лучше, потому что клетки быстрее размножались. Этот же эффект исследователи воспроизвели и в лаборатории: выращивая клетки на гелях разной жесткости, они подтвердили, что судьба клеток зависит не от конкретных молекул, а только от натяжения в ткани.
…
Похожим свойством обладают, например, и клетки соединительной ткани. А это ставит под вопрос идею омоложения тканей стволовыми клетками: оказавшись заперты внутри постаревшего матрикса, они могут попасть под его влияние и потерять свою способность к регенерации
Очень скоро эта область биогеронтологии перестанет быть маргинальной, а там и до замедления старения рукой подать. А то и до реювенации
chrdk.ru/news/verni_molodost_krysam?fbclid=IwAR1P0O7nNz12q58_c03Fu57Zcox67to63LDObFJELFQG5sw_E7Alk6fmFAo
А поясните подробнее,то что сказано в этой статье это хорошо или плохо в вопросе старения?Я немного запуталась в тексте
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Анаэробная нагрузка – плохо, аэробная – если не высокоинтенсивная – хорошо.
В смысле? А как же бег на правильном пульсе?
“…Аэробная нагрузка — плохо…” – Дмитрий, а что Вы подразумеваете под “Аэробная нагрузка” ? И почему это плохо ? Ведь та же ходьба доказано продлевает жизнь и является аэробной нагрузкой ? Или давайте уточнять какой подтип аэробной нагрузки имелся ввиду ? Или просто опечатка и вместо “плохо” должно быть хорошо ? 🙂 Или вместо “Аэробная” должно быть “Анаэробная” ? 🙂
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Анаэробная нагрузка вредна
«…Аэробная нагрузка — плохо…» — Дмитрий, или Вы имели ввиду под “аэробная нагрузка” именно “аэробную” классическую кардио зону пульса больше 70% от 220 минус возраст ?
upload.wikimedia.org/wikipedia/commons/a/ad/Exercise_zones.png
В свое время делал тесты влияния больше 70% и меньше 70% нагрузки на стресс с подачи известного на просторах интернета доктора Звягина (он сам много больше посвятил времени этому) – я попытался проверить в течение нескольких месяцев – и таки да – при нагрузках той же ходьбы в зоне менее 70% (идеально 60-70%) общий стресс организма уменьшался и самое главное (!!!) скорость пульсовой волны понижалась – это очень хороший маркер стрессового состояния если найти способ правильно и недорого/быстро ее измерять (ангиоскан не годится и даже большинство наших узистов, увы, не могут нормально это измерить и вообще не понимают зачем это если 99.9% людей к ним приходят и платят деньги за то, чтобы узнать есть ли холестириновые бляшки и какая толщина КИМ медиа, а то, что скорость пульсовой волны может даже без холестириновых отложений быть плохой из-за той же компенсаторной жесткости стенок сосудов или стрессового состояния организма – они воспринимают как какую-то ересь и вообще зачем это, если за это денег не платят). Это же доказывает с обратной стороны пользу ходьбы т.к. в большинстве случаев для большинства людей ходьба – это все таки нагрузка в малых пульсовых зонах уж точно меньше, чем 70% от 220-возраст – как правило даже меньше 60% для большинства если не спешить и спокойно идти/гулять.
И да, занятия/нагрузки в зоне до 70% не продвинут человека к спортивным рекордам. Но это идеальная нагрузка для поддержания оптимального тонуса без дорогой платы натуживанием/здоровьем за возможность показать какой-то рекорд или выглядеть “круто” в соответствии с текущими представления общества типа у мужика должен быть большой бицепс… бред…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Аэробная нагрузка – это упражнения, во время которых источником энергии являются анаэробные процессы. Это бег на скорость на 800 метров, например, или спарринг 3 минуты. Чем длиннее нагрузка по времени, тем все более она становится аэробной. Так бег на 10 км – это аэробная. Но и аэробная с высокой мощностью не полезна.
Так это плохо или хорошо сто размягчаються эти клетки?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Если размягчается матрикс, то это хорошо. Технологии развиваются. В будущем будет видимо доступно
Дмитрий, Вы почему-то не ответили на мой вопрос. Еще раз дублирую Вам диалог. Мой последний вопрос про бег остался без ответа.
Ольга 17.08.2019 в 23:23
А поясните подробнее,то что сказано в этой статье это хорошо или плохо в вопросе старения?Я немного запуталась в тексте
Дмитрий Веремеенко 18.08.2019 в 13:15
Аэробная нагрузка — плохо
Виктор 18.08.2019 в 16:38
В смысле? А как же бег на правильном пульсе?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Это исправил мой ноутбук автоматически думал, что я пишу “анаэробная”.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Похоже, что пентоксифиллин – один из наиболее сильных антигликаторов
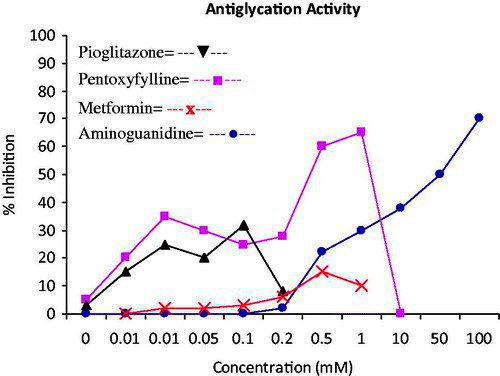
А хибулиновая кислота? Есть же исследование!
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
про чебуловую кислоту – он, похоже, разрушает тот же тип сшивок, что и алагебриум
jstage.jst.go.jp/article/bpb/37/7/37_b14-00034/_html/-char/en
там использовали гликоальдегид для создания сшивок
а, значит, это точно не глюкосепан, а как раз, альфа-дикетоновые сшивки (ну или еще какие похожие), которые только в малых количествах встречаются у млеков
Пока что точно неизвестно из чего образуется глюкозепан Но все равно проблемы не решает Ибо сшивки конкурируют и свято место пусто не бывает Тут же другие сшивки займут его место Гораздо перспективнее выглядит как-тор заменять матрикс вместе со всеми сшивками нежели искать для каждого типа какой-то агент Может этих агентов несколько сотен понадобится
А как сшивки воияют на днк привидите примеры
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Сшивки повышают жесткость внеклеточной среды. Жесткость передается чере механорецептопы в клетку. В клетке через актиновые нити натяжение и давление передается на комплекс линк на яндре клетки. А оттуда это передается на факторы транскрипции. Факторы транскрипции меняют экспрессию генов в ДНК
Получается по графику, что пентоксифиллин и в более низкой дозе, нежели 400мг три раза в сутки, мощно подавляет гликирование , сильнее, чем метформин?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Да. Но это не повод применять его вместо метформина
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Бег трусцой замедляет сшивание коллагена
Moderate exercise has beneficial effects on the accumulation and interaction of AGEs. Rats
subjected to moderate exercise for 12 weeks had lowered levels of MGO and CML, and lower RAGE
expression in aortas, as well as increased activity of glyoxalase 1 and decreased activity of aldose
reductase (Gu et al. 2014). Treadmill-based exercise training, started in late middle age and
continued into senescence (35 months), reduced AGEs accumulation in the heart of rats, in
comparison to age-matched sedentary rats (Wright et al. 2014). Master athletes (life-long regular
endurance runners) had AGE cross-link density in the patellar tendon lower by 21% than age-
matched untrained subjects (Couppé et al. 2014).
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Возможно антиоксиданты не работают на людях потому, что основной КПГ сшивающий коллаген человека глюкосепан, образуется в неокисленных условиях
х Despite its structural
homology with pentosidine (17 ), glucosepane (21 ) is unique
amongst AGEs because it is primarily formed under non-
oxidative conditions.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
ncbi.nlm.nih.gov/pubmed/7616759/
в легких коллаген прекрасно сшивается
не хватает скорости оборота коллагена
researchgate.net/publication/15535878_Evidence_for_Maillard_reaction_in_rat_lung_collagen_and_its_relationship_with_solubility_and_age
Было бы очень хорошо, если бы были выпуски видео или статьи с различными учёными в сфере продления жизни… Если не видео, так интервью в виде текста… С вопросами, которые максимально прояснят данную тему с их точки зрения…наиболее дельные вопросы и поменьше воды
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Все виджео, которые стоит посмотреть я публикую. А видео тех, кто говорит про теломеры и сенесцентные и прочее клетки не публикую, чтобы не вводить всех в заблуждение. Люди ведь доверчивые.
Дмитрий, решил ещё несколько интересных исследований показать…
Вот в этом
habr.com/ru/post/459116/
Речь идёт о исследовании где нашли причину атрофии тимуса, пришли к выводу что он после 20 лет уменьшается из-за того,что его стволовые клетки перестают его обновлять…а они перестают работать из-за повышения выработки фоллистатина при половом созревании и они теряют свои функции из-за того, что организм так специально сделан, и матрикс то молодой ещё…также у диабетиков глюкозепана в разы больше,но они выглядят допустим 60 лет приблизительно так же, как и люди без диабета… а не старцами под 100…
Ведь тимус важный иммунный орган,зачем организм плавно его начинает убивать…Так специально задумано в схеме организма, чтобы мы прожили как задумано….и вероятность смерти начинала возрастать с каждым прожитым годом,после запланированного этапа
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Поразительно но снижение функции тимуса связано с меньшей смертностью. Похоже тимум сделал свое дело в созревании, а дальше не омо нужен. Ведь он и воспаление может повышать. А в старости это не нужно
Дмитрий, я как то видел передачу по телевизору,так там ученый говорил,что с помощью пересадки молодого тимуса старым животным удалось продлить жизнь, да и в интернете если поискать есть такие исследования…
Ещё хотел добавить что ведь у человека могли быть гены от рака также активны,как и у слонов,но за счет меньшего количества клеток мы бы редко болели раком,но нет же, всё сделано так,чтобы мы жили строго определенное время…и этому способствует…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Возможно короткоживущим. Догоживущим мышам не пересаживали. А у людей лучшая функция тимуса связано с более высокой смертностью.
Рома, да, диабетики не выглядят старше своих лет, у них состояние кожи примерно в среднем такое же, как и у людей без диабета.
Старше своих лет выглядят люди (хуже состояние кожи с возрастом )- пребывающие в постоянном стрессе, депрессивные, сильно волнительные и переживалистые. Также обильно курящие и пьющие и другие наркоманы – выглядят старше своих лет. Ещё в эту категорию можно добавить работающих в ночную смену и других бодрствующих ночью. Качки – употребляющие стероиды и т.п. тоже лицом выглядят прилично старше своих лет.
Моложе своих лет выглядят (ощутимо лучше состояние кожи с возрастом) – люди спокойные, флегматичные, оптимистчные и стрессоустойчивые. Также веганы и другие с низким ИФР-1 (Лароны, люди с поздним половым созреванием). Ещё люди живущие в комфортных психологических, экологических, природных и материальных условиях – выглядят в среднем моложе.
Видимо все эти факторы – влияют на внеклеточный матрикс.
Кастраты,которых кастрировали чем раньше, тем лучше выглядят очень молодо для своих лет…после определенного этапа, это похоже не работает(после полового созревания)…и похоже что люди с синдромом Ларона…Вот нету таких исследований, как например сможет ли продлить жизнь ещё больше одновременное кастрирование и синдромом Ларона мышам, чем по отдельности…спорить бессмысленно, нужно проверять и смотреть по факту…также как влияет донорство крови и количество секса на продолжительность жизни мышей…
Читал как-то про кастратов певцов в Европе 17-19 веков, они там тогда были настоящими звездами. Их кастрировали обычно в 7-9 лет, так вот они росли медленнее сверстников, но гораздо дольше и в итоге нередко вырастали до 2 метрового роста (питались они хорошо, потому как были обеспечены деньгами). Потом они начинали жиреть и от этого было много проблем со здоровьем.
А вот корейские придворные кастраты по хроникам жили в среднем на 20-30 лет дольше других придворных и бывало доживали до 110 лет – без всякой современной медицины.
Насчет качков употребляющих стероиды – часто да, но иногда – нет. Например Майкл О’Херн, которому сейчас 50, и который начал выступать на бодибилдерских конкурсах с 14 лет, выглядит отлично.
При этом у него высокий рост – 191 см, огромный вес – >120 чистых мышц и жим лежа >200 кг. Недавно ребенок родился.
Дмитрий, Вы писали:”Но все заканчивается в 95-100 лет. Когда за счет сшивания матрикс набирает достаточную жесткость, воздействие которой уже не покрывается модифицирующими факторами.” Значит в этом возрасте связка сартан+статин уже бесполезна для КИМ, как и другие манипуляции. Только генетика может сыграть свою роль какое-то время?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Генетика не при чем. А этом возрасте нужно разбивать сшивки матрикса глюкосепановые. Может быть это поможет
А проверить это предроложение как то можно,ну есть же такое что берут какую то группу людей и на них проверяют.Как вот со всякими там клиническими испытаниями
Ещё как идея, научиться на порядки раз активировать механизмы, которые обслуживают матрикс и не допускают сшивки (разбивают имеющиеся). Может гены какие то для этого активировать или фарм. препараты создать.
Я думаю что в этом пока вся и загвоздка что не щнают какие гены
Наверно сенесцентные клетки зужк матрикса и их удаление маоую пользу да даст
Дмитрий, Если математически подходить к сенесцентным елеткам, то они наверно зуже матрикса по качеству своему. Поэтому их уничтожение будет малой пользой. И даже если это польза продлится два дня, то сколько дней можно к жизини приплюсовать ?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Мышам удаление сенесцентных клеток не продлила жизнь больше, чем низкокалорийное питание. А мышам, которые живут 1500 дней не продлевает жизнь ничего.
То есть для тех, кто проживет 100 лет – уничтожение сенесцентных клеток ничего не даст
Для остальных может немного продлить жизнь или немного сократить – сенесцентные клетки и вредны и полезны. ЧТо перевесит
А скажите почему в приорите для исследования у всех ученых мыши на них проводят всякие испытания.Я слышала что у Свиней организм очень похож на человеческий,мне кажеться легчи бы тогда было тестировать на них
Дмитрий, розувастатин тоже ромогает матриксу. Но его нет в статье.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Он не помогает у розувастатина роль для матрикса спорная. Пока мало данных
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Матрисома во время старения и долголетия: Системный подход к определению матреотипов, способствующих здоровому старению.
Автор использует системный подход к количественной оценке матрисомных или ECM-композиций, отражающих здоровье, патологию или фенотип, и предлагает новый термин, “матреотип”, для его описания.
Матреотип определяется как состав и модификация ECM или матрисомных белков, связанных с фенотипом или вызванных им, например, долгожительством, или выраженным и острым физиологическим состоянием, наблюдаемым при старении или болезнях.
Каждый тип клеток производит свой уникальный ECM. Интересно, что типы раковых клеток могут быть даже идентифицированы по их уникальному составу ECM.
Таким образом, матреотип отражает клеточную идентичность и физиологический статус. Определенные матреотипы могут быть использованы в качестве биомаркеров или прогностических факторов, определяющих состояние здоровья или заболевания во время старения и имеющих потенциальное значение для персонализированной медицины.
Лечение биологическими препаратами, изменяющими механотрансдукцию от ECM к клетке, может быть стратегией обращения вспять возрастных патологий.
Понимание того, как перейти от старого к молодому матреотипу может указывать на новые стратегии омоложения клеток и помогать поддерживать гомеостаз тканей для улучшения здоровья во время старения.
preprints.org/manuscript/201908.0063/v1
Accumulation of damage is generally considered the cause of aging. Interventions that delay aging mobilize mechanisms that protect and repair cellular components. Consequently, research has been focused on studying the protective and homeostatic mechanisms within cells. However, in humans and other multicellular organisms, cells are surrounded by extracellular matrices (ECM), which are important for tissue structure, function and intercellular communication. During aging, components of the ECM become damaged through fragmentation, glycation, crosslinking, and accumulation of protein aggregation, all of which contribute to age-related pathologies. Interestingly, placing senescent cells into a young ECM rejuvenates them and we found that many longevity-assurances pathways re-activate de-novosynthesis of ECM proteins during aging. This raises the question of what constitutes a young ECM to reverse aging or maintain health? In order to make inroads to answering this question, I suggest a systems-level approach of quantifying the matrisome or ECM compositions reflecting health, pathology, or phenotype and propose a novel term, the “matreotype”, to describe this. The matreotype is defined as the composition and modification of ECM or matrisome proteins associated with or caused by a phenotype, such as longevity, or a distinct and acute physiological state, as observed during aging or disease. Every cell type produces its unique ECM. Interestingly, cancer-cell types can even be identified based on their unique ECM composition. Thus, the matreotype reflects cellular identity and physiological status. Defined matreotypes could be used as biomarkers or prognostic factors for disease or health status during aging with potential relevance for personalized medicine. Treatment with biologics that alter ECM-to-cell mechanotransduction might be a strategy to reverse age-associated pathologies. An understanding of how to reverse from an old to a young matreotype might point towards novel strategies to rejuvenate cells and help maintain tissue homeostasis to promote health during aging.
Дмитрий, у меня два вопроса.
1. В ваших статьях вы часто упоминаете, что повышенный гормон роста и вслед за ним игф-1 являются основными причинами укорочения жизни.
Но вместе с этим, идет речь о том, что пока ткани растут то мы не стареем. Да я помню за мутации и опухоли от этого, Но что если использовать гормон роста и при этом контролировать пагубные процессы добиваясь роста/обновления тканей без опухолей?
2. Точно знаю что такую терапию (например гормон роста+метформин+тироксин..) используют специалисты на западе по отношению к некотрым состоятельным людям ( например актер сталоне и мадонна и т.д) Как видно, с ними это вполне работает. Как вы к этому относитесь?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Гормон роста приводит к ускоренному старению за счет многих других механизмов
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Ученый Саша Фединцев считает, что скавенджеры метилглиоксаля и других ПОЛ (туда же можно D-PUFA отнести) будут неэффективны против старения (по крайней мере, человека), так как основной КПГ – это глюкосепан, а он образуется ТОЛЬКО в результате реакции глюкозы с лизином (или аргинином, но это не точно) jbc.org/content/280/13/12310
In nondiabetic controls, levels at 90 years were 2000, 30, and 15 pmol/mg for glucosepane, MODIC, and GODIC, respectively.
2000 у глюкосепана против 45 у ПОЛ (перикисное окисление липидов)
это negligible
Именно это причина провала dPUFAs
Можно представить какой эффект будет у ингибиторов глюкосепана, если ингибиторы ПОЛ процентов на 6 продлили жизнь мышатам!
Если линейно экстраполировать, то на 266%
Может ли быть ПОЛ катализатором? При воспаление уровень КПГ растет в тканях. Поэтому не стоит так сразу dPUFA хоронить. Они защищают мембраны и предотвращают индуцированное ПОЛ воспаление.
Ну и ½ метилглиоксаля из ПОЛ получатся.
образование сшивок ускоряют металлы, а телмисартан – сильный хелатор металлов
Похоже, что глюкосепан виновен процентов на 95%.
А он бы взял и проверил это на мышах или так нельзя?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Проверять похоже нужно обязательно на людях. Мыши только предворительный результат. Мыши стареют совсем иначе
А на людях нельзя проверять?Есть же какие то вот группы котрые проходят клинические исследлвания.Или у нас такое запрещкно законом?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Если не было проверки на животных мышах, то на людях нельзя
>Ученый Саша Фединцев считает, что скавенджеры метилглиоксаля и других ПОЛ (туда же можно D-PUFA отнести) будут неэффективны против старения (по крайней мере, человека), так как основной КПГ — это глюкосепан, а он образуется ТОЛЬКО в результате реакции глюкозы с лизином (или аргинином)
Дмитрий, так может нужно до возможного здорового минимума снизить в организме содержание глюкозы, лизина и аргинина?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Это не зависит от них.
А почему удаляются гликозаминогликаны в старости?
А что если найти способ поддерживать активность гликозаминогликана, чтобы CatK своевременно разрушал или ремоделировал старый коллаген для обновления матрикса?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Это нужно выяснять.
Дмитрий,Спасибо интересная статья,да мошенников сейчас развелось много котрые за 100-200 тыс предлогают волшебные таблеточки(бады или плацебо)котрые якобы позводят омолодиться. Но при этом нет никаких доказательств с научной точки зрения что это так.
Если не удается омолодить внеклеточный матрикс остается его создать заново для отдельных органов человека.
Статься отсюда health.mail.ru/news/rabotayuschie_chasti_serdtsa_napechatali_na/
Статья группы специалистов по биоинженерии из Университета Карнеги Меллон (США) опубликована в журнале Science. science.sciencemag.org/content/365/6452/482
Технология FRESH позволяет создать внеклеточный матрикс — биологический каркас, структурную основу органов и тканей человеческого организма — из его главного естественного компонента, белка коллагена. До сих пор было невозможно с помощью методов биоинженерии воспроизвести всю сложнейшую архитектуру внеклеточного матрикса. Кроме того, при попытке создания матрикса на основе коллагена ученые сталкивались с проблемой деформации белковых структур.
Создателям FRESH удалось преодолеть все эти трудности и сделать технологию более простой и доступной. Во-первых, на основе данных магнитно-резонансной томографии ученые смогли точно воспроизвести анатомическую структуру сердца конкретного пациента со всеми ее индивидуальными особенностями. Во-вторых, чтобы избежать деформации коллагеновых структур во время процесса 3D-биопечати, белок накладывают слой за слоем в среде из специального поддерживающего геля.
Когда коллаген застывает, гель легко растворяется путем нагревания от комнатной температуры до температуры человеческого тела, не повреждая напечатанный коллагеновый каркас. Гель также позволяет создать подходящие условия для роста и развития кардиомиоцитов — клеток сердечной мышцы, которыми «заселяют» каркас, чтобы вырастить участок сердца.
С помощью такого метода ученые получили пять нормально функционирующих компонентов человеческого сердца, включая сердечный клапан и сокращающийся желудочек. Разработчики FRESH уверены, что благодаря этой технологии стал возможен прорыв в сфере трансплантации. Подобные коллагеновые каркасы можно «печатать» для получения любых человеческих органов и тканей, с тем чтобы затем использовать их для пересадки. В недалеком будущем сравнительно дешевые и высокопроизводительные 3D-биопринтеры будут широко использоваться в регенеративной медицине как для заживления ран, так и для выращивания биоинженерных органов, уверены ученые.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Такие работы ведутся. Но их применить сложно. Отказало сердце. нужно растить новое, нужно время. Можно не успеть
А нет какой то тнхнологии ускорения роста этих клеток,тогда бы и орган рос быстрее
А допустим вот человеку нужна пересадка и например как я знаю вот год ищут сердце ему,он же это время как то под аппаратами там находитьбся.Может за год можно просто выростить сердце и пересадить
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Это да. Я просто говорил, что это все непросто.
Привет,Дмитрий
Вопрос немножко не по теме.
Расскажи пожалуйста про alpha-gpc.
Что это и кому можно пить.
С уважением,
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Можно полное название.
Вообще все, чего нет на этом блогеч пить не нужно. На этом блоге все, что проверено. Остальное проверено заполняет чьи-то карманы деньгами
Дмитри,Мне вот интересно,а почему ваш проэкт не поддерживают всякие политики,звезды вед это самая актуальеая тема,тем более звезды например первые кто стремяться быть “вечно молодыми”.А то по телевизору показывают всякие передачи Малвшевой и.т.д.Лучше бы вас показывали чтоб люди начали вести правельный образ жизни
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Я не рассказываю сказки.
Они любят сказки.
Ну вы зато рассказываете правду основаю на кленических иследованиях.И своей информацией помогаете людям.Я думалв что в наше время люди уже должны научиться не верить в сказки
Дмитрий,Вы зато интересно рассказываете я смотрела ваши вебинары,максимально четко и без воды.И не рассказываете про волшебную таблеточку которую выпьешь и все можно ничего не делать она сама все сделает
Хотелось бы добавить,что ещё аутофагия повышала максимальную продолжительность жизни
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
максимальную продолжительность жизни ГРУППЫ МЫШЕЙ, но не максимальную продолжительность жизни мышей. Это разные вещи.
Так если нас собрать 100 человек, то с большой вероятностью аутофагия может продлить максимальную продолжительность жизни нашей группы 100 человек. Но не продлит максимальную продолжительность жизни нескольких миллиардов населения на планете, так как среди нас уже есть те, у кого оптимально организована аутофагия и эти люди уже поставили рекорд в 101-117 лет жизни.
Дмитрий,читал что в органах есть специализированные клетки которые вообще не делятся всю жизнь,то есть органы не полностью обновляются(в плане клеток),а есть зоны где клетки не заменяются,а живут и не делятся всю жизнь и так во всех органах которые исследовали…
“Почти никто из нас похоже не сможет прожить больше 100 лет. И только счастливчики доживут до 101-117 лет” – читается так, будто Вы решили, что старение не победить, сайт закрываю.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
А вы решили, что до 100 лет прожить легко. Сайт о том как прожить до 100 лет и о том, что наука делает, чтобы победить старение вообще. Или все, науку закрываем только потому, что именно сегодня нельзя прожить больше 100?
Человек просто говорит с какой то обреченностью видемо не совсем правильно воспринял вашу информацию и решил что все безнадежно.Я думаю что наука не стоит на месте как и вы с вашими иследованиями,и мы не знаем что будет завтра через 10,15 лет.А может быть способ все таки найдеться,почему нет.Раньше вон больных оспой,чумо считали безнадежными,а сегодня лечат.Как и рак я слышала по тихоньку учаться лечить.Думаю так же и тут
На сегодняшний момент все так и есть… В среднем 70-80 лет, некоторые генетические мутанты могут прожить и до 122 лет (научно доказано), но это единицы… Шанс даже меньше, чем вероятность стать долларовым миллиардером… Так будет пока наука не решит эту проблему… А пока миллиарды пробулькиваются на всякую чепуху… Когда столько вопросов неизвестно по данной крайне важной теме
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
122 года научно недоказано. Жанна Кальман разоблачена.
Следующий долгожитель 117 лет
Вроде уже реабилитирована
nashagazeta.ch/news/education-et-science/zhanna-kalman-deystvitelno-prozhila-122-goda
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
нет. Это бездоказательно. Просто Французы не хотят сдаваться. Расследованием занимается мой друг ученый. Я знаю из первых рук
Дмитрий вы написали,что в отличии от одноклеточных,у многоклеточных клетки могут обновляться за счет стволовых,но стволовые, как известно теряют способность обновлять ткани с возрастом…Нашел исследования,где учёные пытались понять причины этого…в мозге стволовые клетки постепенно замещаются на обычные стареющие, из-за того, что стволовые клетки делятся несимметрично чаще,чем симметрично…то есть из одной стволовой клетки чаще получается 1 стволовая,а другая обычная стареющая,в итоге в ограниченном пространстве они всё со временем переходят в специализированные(обычные стареющие), без воздействия матрикса….а в кишечнике есть сигнальные молекулы notum которые не дают стволовым обновлять ткани и если их убрать,то кишечник омолаживается,без влияния матрикса…матрикс безусловно важен,но каково значение этого влияния на продолжительность жизни среднестатистического организма для меня пока не понятна…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Стволовые перестают с возрастом по двум причинам.
1. Стареют стволовые ниши – это матрикс на котором живут стволовые клетки. И стволовые клетки тоже начинают стареть. А симметричность и не симметричность не причем.
2. Стволовые клетки не могут омолаживать, так как стареющий матрикс не позволяет – об этом подробно написано в данной статье, к которой вы пишите этот комментарий.
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
ДА. Интересно замечание.
у одноклеточных роль матрикса играет мембрана, скорее всего. Материнская клетка дрожжей не обновляет мембрану и в ней накапливаются повреждения, а дочерние клетки строят мембрану заново
Также вопрос,почему с помощью специальных сигнальных молекул,удаётся обновить ткани у старых организмов с учетом того, что они находятся в старом матриксе…Матрикс безусловно крайне важен для продолжительности жизни,другое дело насколько он влияет на скорость старение в среднестатистический организм…если бы клетки не старели(обслуживающие матрикс) на сколько бы изменился матрикс?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
В полностю состаренном матриксе не омолодить клетки. Покажите исследование, я прокомментирую
sciencedaily.com/releases/2019/07/190710132002.htm
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Пока матрикс недостаточно жесткий, то можно откатывать функциональный возраст органов и тканей. Так можно сделать сердце помоложе, сосуды помоложе. Это можно сделать за счет модифицирующих факторов. Например, оксид азота из-за спортивных тренировок делает сосуды мягче. Но все заканчивается в 95-100 лет. Когда за счет сшивания матрикс набирает достаточную жесткость, воздействие которой уже не покрывается модифицирующими факторами. Поэтому люди и могут выглядеть по разному – одни моложе, другие старше. Но конец у всех один к 95-100 годам.
Наткнулся ранее на статью, в которой речь шла о том, что при увеличении теломеразы, за счёт чего удлиняются теломеры, клетка способна делится уже не 50, а 90 раз…возникает вопрос,почему в этой статье клетки всё-равно переставали делится на 90 раз,а не делились бесконечно…Также нужен график который показывал бы,как возрастает вероятность превращения в раковую клетку этих клеток от количества раз деления,так как если она будет превращаться по факту только на 1000 делении,то это многое прояснит…Вот ещё хотел написать о том,что у слонов нашли гены препятствующие раку,так как клеток у них много,а живут достаточно долго…они есть у человека,но их работа более слабо работает у человека…организм ведь может усиливать работу генов,но он не хочет это делать,он знает когда мы должны умереть и рак это свое рода ускоритель смерти, организм знает, что пора перестать сопротивляться раку
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Если клетка будет делиться бесконечно, то она станет раковой. теломеры для того и созданы, чтобы избегать рака. И чем длиннее теломеры у животных, тем животные меньше живут.
Про теломеры читайте здесь
https://nestarenie.ru/telomeryi.html
и здесь
https://nestarenie.ru/ogranichenie-deleniya-kletok.html
У слоном просто больше пар p53. Никакой программы.
Дмитрий,неделю назад читал новую статью,в которой была указана скорость укорочения теломер у разных животных,так вот у мышей теломеры укорачиваются очень быстро относительно других видов…Если бы теломеры были у них ещё и короткие,то они бы жили ещё меньше,а так за счёт длинных теломер они живут сколько надо
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Их теломеры укорачиваются быстро из-за старения. Так как укорочение теломер – это не причина, а следствие старения. А мыши стареют и умирает всего в среднем за 2 года.
Есть к примеру исследования,в которых мыши с короткими теломерами доказано живут меньше,есть и обратные исследования в которых правильное удлинение теломер продлевает значительно жизнь…То есть длина теломер также влияет на продолжительность жизни…укорочение теломер это следствие…но оно затрагивает нижележащие причины старения…интересно как влияет на продолжительность жизни скорость деления клеток…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Теломеры – это следствие. Удлинение теломеров в рамках одного вида и продлевало жизнь немного и сокращало
Есть кстати исследование,в котором замеряли длину теломер у чаек(у одного вида животных,а не разных,что может запутать выводы),и проверяли какие дольше проживут…в итоге,чем длиннее теломеры у чаек были,тем в среднем они дольше жили,а чем короче,тем меньше…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
А рамках одного вида, да. Потому, что более длинные теломеры у более здоровых, так же как более высокая температура у больных. Но не температура вызывает болезень, а болезнь вызывает температуру.
Дмитрий,вы написали что:”в рамках одного вида, да. Потому, что более длинные теломеры у более здоровых, так же как более высокая температура у больных. Но не температура вызывает болезнь, а болезнь вызывает температуру.”…что в принципе логично…
Но почему тогда генное удлинение теломер продлевает максимальную продолжительность жизни мышей на 40% без увеличения рака(при правильном удлинении)…это по приведенной вами аналогии получается что снижение температуры делает человека здоровым…Ну так ведь?То есть это уже не совсем следствие…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Там был ряд экспериментов. В большинстве из них мышам жизнь сократили. И только в одном продлили. То есть просто угадали оптимум длинны теломеров именно для этой группы мышей. И да. Не стоит сравнивать максимальную продолжительность жизни группы мышей и нескольких миллиардов человек.
Ведь, все, что продлевало мпж групп мышей, продлевало мпж не долгоживущих мышей. Так мышам с нокаутом генов, кодирующих рецепторы гормона роста уже ни что мпж не продлевало вообще ни на 1%. Они живут около 1500 дней. 1500 дней для мышей – это 100 лет для людей. И вот как ничто не продлевает людям жизнь более 100 лет, так ничто не продлевало мышам более 1500 дней. И только счастливчики люди живут от 101 до 117 лет. А рекордная мышь счастливчик прожила около 1800 дней.
А с теломерами играли на мышах, которые жили 1000 дней. В ряде экспериментов им сократиои жизнь. В одном им продлили до 1200 дней. Это как повезет не повезет. И это еще группа была однородная. А мы все люди разные.
В переводе на жизнь людей – это означало что 75 лет продлили до 90. И это значит, что мпж человека это не продлит, так как теломеры и не продлевали мпж мышей. А мпж группы – это мпж группы олнородной по генетике. Я бы даже дал этому другое название, чтобы потом с мпж людей не путать. Мпж мышей 1800 дней. И никакие теломеры это не продлевали.
Но и это не так. Дело в том, что долгоживущие животные в отличии от мышей характеризуются тем, что у них процент сенесцентных клеток намного больше из-за более коротких теломеров. Это нужно и для защиты от онкологии, иначе бы мы умирали как мыши, а мыши дикого типа и долгоживущие умирают от рака. Еще нам это нужно для защиты от фиброза, как долгоживущим. Теломеры укорачиваются от меньшего количества делений у нас, что переводит потом такую клетку в состояние сенесцентности. У нас, как у долгоживущих часто возникает фиброз. И сенесцентные клетки защищают нас от фиброза. И скорее всего удлинение теломеров долгодивущим будет сокращать жизнь, так как именно сокращение теломеров – это приспособление долгоживущих.
Дмитрий есть исследование, в котором говорилось, что клетки с короткими теломерами крайне нестабильные, их хромосомы слипаются друг с другом концами, что существенно повышает риск рака…выходит либо их надо убивать и заменять новой из столовой клетки(если конечно в стволовых не накапливаются достаточно быстро ошибки при делении клетки) или оптимально удлининить теломеры(не избыточно) в обычных, опять же предварительно определив через сколько делений обычная клетка начинает превращаться в раковую… оставлять все как есть не вариант…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Представьте себе, что есть 5 клеток, длинна теломеров которых
1 клетка – 10 единиц (не важно каких, просто для наглядности)
2 клетка – 9 единиц
3 клетка – 6 единиц
4 клетка – 9 единиц
5 клетка – 4 единиц
Средняя длинна теломеров = (10+9+6+9+4) = 7,6
——
Постепенно одни теломеры сокращаются, но на смену приходят новые клетки с новыми теломерами
1 клетка – 9 единиц
2 клетка – 8 единиц
3 клетка – 5 единиц
4 клетка – 8 единиц
новая клетка 5 клетка – 10 единиц
Средняя длинна теломеров = (9+8+5+8+10) = 8
—-
Как видим одни клетки стареют, их теломеры укорачиваются, а им на смену приходят новые и никаких проблем – средняя длинна теломеров где-то тоже.
—-
Но вот мы стареем. Стареет внеклеточный матрикс. Стволовые ниши, где находятся стволовые клетки – тоже внеклеточный матрикс. О стареющие стволовые ниши старят стволовые клетки. Их становится все меньше. Некоторые, становятся старыми и уничтожаются. В итоге на замену состаренным клеткам организма приходят все меньше новых клеток. И средняя длинна теломеров с возрастом снижается. Но не в теломерах дело, а в стволовых нишах.
Ну удлинили мы таким клеткам теломеры. Даже если не будет никаких рисков онкологии, то это даст лишь небольшую временную отдышку. У клеток роль матрикса играет мембрана, скорее всего. Материнская клетка дрожжей не обновляет мембрану и в ней накапливаются повреждения, а дочерние клетки строят мембрану заново. Матрикс дает сигналы через рецепторы на уничтожение клеток и с определенного возраста уже ничто не сможет удлинить теломеры. Напомню (мыши живут 2 года). А люди много, матрикс людей более жесткий. И им в старости же удлиняй, не удлиняй теломеры, а матрикс изо сразу старит, как было в том же примере с матрасом сердца (sci-hub.se/10.1016/j.jacbts.2019.03.004#).
То есть короткие теломеры – это плохо, но их сокращение – это следствие. Их удлинение проблемы не решат, а лишь могут дать некоторые временные преимущества и то не всем линиями мышей, и скорее всего не дадут людям. Так как такое удлинений тут же будет нейтрализовано матрасом на сокращение
Там также говорилось, что хромосомы с короткими теломерами это как шнурки от батинок без пластикового наконечника(они без него расплетаются)… В итоге хромосомы также расплетаются, что приводит к нестабильности генома…
Не хватает также информации о том,какие комбинации разных способов продления жизни работают синергично,а какие нет…(снижение ошибок ДНК, улучшение липидного состава мембраны клеток, уничтожение сенесцентных (стареющих) клеток сенолитиками, терапия снижающая системное воспаление, борьба со свободными радикалами, удлинение теломеров(оптимальное,так как слишком длинные теломеры также ухудшают работу ДНК), улучшение митохондрий, эпигенетический откат,редактирование генома(усиление работы генов долголетия и снижение работы генов ускоряющих смерть)…Ведь есть массу разных методов, которые доказано продлевали даже максимальную продолжительность жизни модельным животным, и организм в принципе некоторыми способами мог бы сам увеличить себе жизнь, но он этого делать не хочет,так как запрограммирован на определенный срок жизни…мне кажется, что к примеру кастрация эффективна для продления жизни(именно начатая с самого детства,так как после полового созревания не работает) просто продлевает этап периода детства в программе, после полового созревания этот этап уже пройден и она уже не работает…Также встаёт вопрос почему спермотозоиды,вирусы,одноклеточные у которых нет внеклеточного матрикса живут очень недолго(по прочитанной ранее информации вроде из-за накопленных ошибок ДНК и/или программы которая контролирует срок жизни)…Эта программа точно знает до скольки лет у нас детства,когда половое созревание,когда зрелость и когда будет старость(+- совсем небольшие отклонения у разных людей в среднем), также и она указывает, какого размера будет каждый орган и тело, она задают лимит размера…
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Животные не в счет. Они короткоживущие – мыши живут 2 года. У них не успевает состариться матрикс. И да. У мышей с нокаутом гена кодирующего рецепторы гормона роста, которые живут около 5 лет, матрикс уже состарился больше и им уже ничего вообще и никак жизнь не продлевает. Поэтому, все, что вы перечислили никак не продлевает жизнь даже 5-летним мышам, даже если все собрать вместе. А человеку – подавно. Только матрикс. Все остальное не работает.
ВЫ ПИШИТЕ: “ак как запрограммирован на определенный срок жизни…”
ОТВЕТ: “нет у млекопитающих никакой запрограммированности старения”. Программы старения есть только у некоторых короткоживущих растений и простых животных, типа рыб. Дальше никакой программы не существует.
ВЫ ПИШИТЕ: “Также встаёт вопрос почему спермотозоиды,вирусы,одноклеточные у которых нет внеклеточного матрикса живут очень недолго”
ОТВЕТ:”Потому, что отдельные клетки имеют ограниченный срок жизни, а долго живет только многоклеточный организм, в котором одни клетки умирают, но на их место рождаются новые.”
ВЫ ПИШИТЕ “Эта программа точно знает до скольки лет у нас детства,когда половое созревание,когда зрелость и когда будет старость(+- совсем небольшие отклонения у разных людей в среднем), также и она указывает, какого размера будет каждый орган и тело, она задают лимит размера…”
ОТВЕТ: как я и говорил, никакой программы нет старения у человека нет. Программа развития есть, но не старения. Есть только фантазии и желание найти программу старения, там где ее нет. А стадии развития зависят от состояния матрикса. Сначала команду дает матрикс, зачем клетки действуют на основании команд матрикса. То есть в ДНК клетки записано, как реагировать на команды матрикса.
Т.е если гипотетически, разрушив сшивки глюкозепана и другие===можно омолодить себя до состояния младенца(мягкости матрикса), но при этом иметь размеры взрослого мужчины???
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
Конечно взрослого.
Значит, мы на правильном пути, начав употреблять лекарства, добавки, продукты, пользу которых для нас открыл Дмитрий.За что Вам,Дмитрий, огромное спасибо!
Спасибо Дмитрий
А можете скинуть ссылку исследования, в котором молодой внеклеточный матрикс обновлял старые клетки?
Рекомендует только врач. Я не врач, но делюсь данными исследований.
Отрезайте у ссылок http:
https://nestarenie.ru/matriks.html